
【题目】已知A是一种重要的基本化工原料,能使溴的四氯化碳溶液褪色,其产量常用于衡量一个国家石油化工发展水平的标志,也是一种植物生长调节剂。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)B的官能团的名称是 ,G是一种高分子化合物,其链节是 。
(2)由A生成F的反应类型是 反应,B生成C的化学方程式是 。
(3)B和D反应生成E的化学方程式是 ,该反应类型是反应 。
(4)工业上用30吨D与46吨B反应,如果实际产率是理论产率的67%,则实际可得到的E的质量是 (保留四位有效数字)。
【答案】(1)羟基(有错别字不给分)(1分) —CH2—CH2—(1分)
(2)加成(1分);2CH3CH2OH+O2![]() 2CH3CHO+2H2O(2分);
2CH3CHO+2H2O(2分);
(3)CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O(2分)
CH3COOCH2CH3+H2O(2分)
酯化或取代(有错别字不给分)(1分)
(4)29.48吨(2分)(不写单位扣1分)
【解析】
试题分析:A是一种重要的基本化工原料,能使溴的四氯化碳溶液褪色,其产量常用于衡量一个国家石油化工发展水平的标志,也是一种植物生长调节剂,则A是乙烯,结构简式是CH2=CH2,乙烯与水发生加成反应产生的B是CH3CH2OH;CH3CH2OH在Cu作催化剂时被氧化产生C是乙醛,结构简式是CH3CHO;乙醇被酸性高锰酸钾溶液氧化产生D是乙酸CH3COOH;乙醇与乙酸在浓硫酸作用下,加热发生酯化反应产生E:乙酸乙酯;乙烯与HCl发生加成反应产生F:氯乙烷CH3CH2Cl;在一定条件下发生加聚反应产生G聚乙烯:![]() 。(1)B是乙醇,官能团是羟基,G是一种高分子化合物聚乙烯,其链节是—CH2—CH2—。(2)由A生成F的反应类型是加成反应,乙醇被催化氧化产生乙醛的化学方程式是2CH3CH2OH+O2
。(1)B是乙醇,官能团是羟基,G是一种高分子化合物聚乙烯,其链节是—CH2—CH2—。(2)由A生成F的反应类型是加成反应,乙醇被催化氧化产生乙醛的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O。(3)乙醇与乙酸在浓硫酸作用下,加热发生酯化反应产生乙酸乙酯和水,酯化反应也是取代反应。B和D反应生成E的化学方程式是CH3CH2OH+ CH3COOH
2CH3CHO+2H2O。(3)乙醇与乙酸在浓硫酸作用下,加热发生酯化反应产生乙酸乙酯和水,酯化反应也是取代反应。B和D反应生成E的化学方程式是CH3CH2OH+ CH3COOH![]() CH3COOCH2CH3+H2O。(4)乙酸的相对分子质量是60,, 30吨乙酸的物质的量是n(CH3COOH)=30×107g÷60g/mol=5×106mol,乙醇的相对分子质量是46,46吨乙醇的物质的量是n(CH3CH2OH)=46×106g÷46tg/mol=1×106mol,由于二者反应的物质的量的比是1:1,可见乙醇过量,如果实际产率是理论产率的67%,则反应的乙酸的物质的量是n(CH3COOH)= 5×105mol×67%=3.35×105mol,实际可得到的乙酸乙酯的质量是m(CH3COOCH2CH3)= 3.35×106mol×88g/mol= 2.948×107g= 29.48×106g= 29.48吨。
CH3COOCH2CH3+H2O。(4)乙酸的相对分子质量是60,, 30吨乙酸的物质的量是n(CH3COOH)=30×107g÷60g/mol=5×106mol,乙醇的相对分子质量是46,46吨乙醇的物质的量是n(CH3CH2OH)=46×106g÷46tg/mol=1×106mol,由于二者反应的物质的量的比是1:1,可见乙醇过量,如果实际产率是理论产率的67%,则反应的乙酸的物质的量是n(CH3COOH)= 5×105mol×67%=3.35×105mol,实际可得到的乙酸乙酯的质量是m(CH3COOCH2CH3)= 3.35×106mol×88g/mol= 2.948×107g= 29.48×106g= 29.48吨。


科目:高中化学 来源: 题型:
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
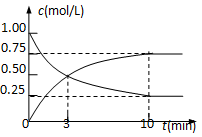
①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用高效催化剂
D.恒温恒容再充入1 mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
![]()
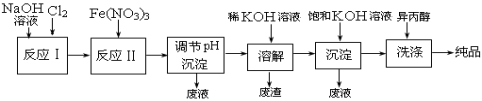
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
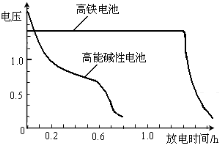
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物种类较多,也大多具有广泛的用途。
I. MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:

①从以上实验中,我们可以得出的结论是_________________________________。
②写出C试管中发生反应的离子方程式:_________________________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:

已知Fe3+、Mn2+沉淀的pH为上表所示。
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_____________________。
②步骤二中需控制pH的范围是 ___________ 。
③步骤三中是否洗涤干净的判断方法是 _______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CO(g) +3H2 (g) ![]() .CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的 是( )
.CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的 是( )

A.上述反应的△H<0
B.N点时的反应速率一定比M点快
C.降低温度,H2的转化率可达到100%
D.工业用此法制取甲烷应采用更高的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂——铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=Cu+2Li++2OH-,下列说法不正确的是
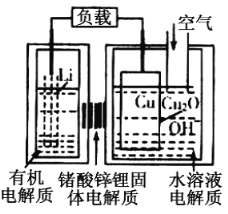
A.通空气时,铜被腐蚀,表面产生Cu2O
B.整个反应过程中,氧化剂为O2 ,Li为还原剂
C.放电时,Li+透过固体电解质向Cu极移动
D.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的说法正确的是
A.液态HCl不导电,所以HCl不是电解质
B.NH3溶于水形成的溶液能导电,所以NH3是电解质
C.稀硫酸能导电,所以稀硫酸是电解质
D.BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
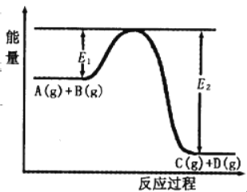
(1)该反应是______反应(填“吸热”“放热”);
(2)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1______,E2______(填“增大”“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?______,(填“是”或“否”)原因是_______________。
(4)该反应的反应热△H=__________kJ/mol。(用E1和E2表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com