
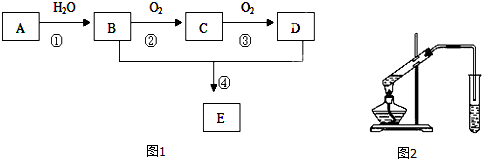
分析 A是一种分子量为28的气态烃,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,乙醛进一步发生氧化反应生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成E为CH3COOCH2CH3;据此分析解答.
解答 解:(1)由上述分析可知,反应①是乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
A是一种分子量为28的气态烃,则A为CH2=CH2,与氢气反应生成F为乙烷CH3CH3,所以F与氯气混合,写出生成一氯代物的方程式:CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl,
标况下取F的同系物G 11.2L即0.5mol点燃,充分燃烧生成二氧化碳和水,将生成物通入澄清石灰水生成碳酸钙沉淀,得碳酸钙沉淀200g即2mol,根据C原子守恒,则G中含有4个C原子,又为F的同系物,所以G为丁烷,可能存在的结构式为CH3CH2CH2CH3为正丁烷,(CH3)2CHCH3为异丁烷;
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;加成反应;CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl;CH3CH2CH2CH3为正丁烷,(CH3)2CHCH3为异丁烷;
(2)B为CH3CH2OH,B分子中的官能团名称是羟基,与钠反应制备氢气,若制得1molH2需要B2mol,故答案为:羟基;2;
(3)B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)实验室用图2所示的装置制取E即乙酸与乙醇在浓硫酸加热条件下生成乙酸乙酯和水,方程式为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,用饱和碳酸钠溶液吸收,故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;饱和碳酸钠溶液;
(5)由上述分析可知,属于烃的即只含有碳、氢元素,所以只有B、CH2=CH2,F、CH3CH3,G、丁烷,分子式分别为C2H4,C2H6,C4H10;
故答案为:C2H4,C2H6,C4H10.
点评 本题考查了有机物的简单推断,是对有机化学基础的综合考查,难度不大,注意对基础知识的理解掌握.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
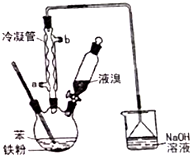 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.| 苯 | 溴苯 | |
| 沸点/℃ | 80 | 156 |
| 水中溶解度 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
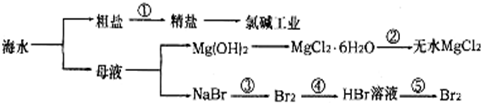
| A. | 过程①需要加入化学试剂、沉淀、过滤等操作 | |
| B. | 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应 | |
| C. | 工业上一般用电解氯化镁溶液制取Mg单质 | |
| D. | 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 热化学方程式中反应热数值的大小与化学方程式的计量数成比例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
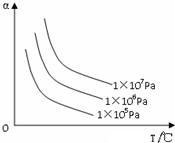
| A. | C(s)+CO2(g)?2CO(g);△H>0 | B. | H2(g)+Br2(g)?2HBr(g);△H<0 | ||
| C. | N2(g)+3H2(g)?2NH3(g);△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加 NH3 的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗 NO 和 N2 的物质的量比为 1:2 时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com