
下列叙述正确的是( )
A.锥形瓶可用作加热的反应器
B.室温下,不能将浓硫酸盛放在铁桶中
C.配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高
D.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是______(填元素符号,下同),第一电离能最小的是________;
 (2)C所在的主族元素气态氢化物中,沸点最低的是______(填化学式);
(2)C所在的主族元素气态氢化物中,沸点最低的是______(填化学式);
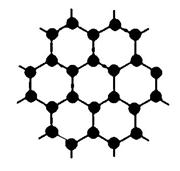
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为____________;
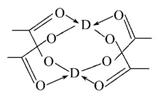 (4)D的醋酸盐晶体局部结构如右图,该晶体中含有的化学键是______(填选项序号);
(4)D的醋酸盐晶体局部结构如右图,该晶体中含有的化学键是______(填选项序号);
①极性键 ②非极性键
③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液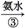 蓝色沉淀
蓝色沉淀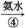 蓝色溶液
蓝色溶液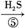 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某有机物C6H12O2能发生水解反应生成A和B,B能氧化成C,若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
普通漏斗(如图)是中学化学实验室中常用仪器之一。我们对它的用途并不陌生。
(1)请举两例说明普通漏斗在化学实验中的运用:
__________。
(2)你是否探讨过在化学实验中创新地使用普通漏斗?请参与到下面的讨论中:
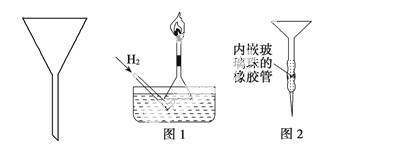
①图1是某同学在实验室中制备H2并检验H2具有可燃性装置的一部分,请说出他这样做的优点:
________________。
②某同学用苯萃取碘水中的碘时,找不到分液漏斗。他灵机一动,先在试管中将混合液充分振荡后静置,然后再用普通漏斗与其他常见实验仪器和用品组装成一个简易分液器进行分液(图2),解了燃眉之急。试分析该设计的不足之处: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事故处理措施正确的是 ( )
A.金属钠着火,立即用泡沫灭火器灭火
B.在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度
C.酒精灯不慎着火,应立即吹熄
D.眼睛里溅进盐酸,立即用NaOH溶液洗涤眼睛
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
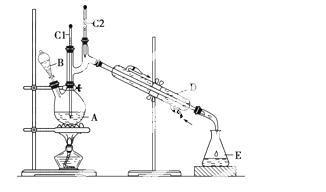
有关仪器和装置回答下列问题:
(1)上述装置图中,仪器C1和C2的名称是________,B仪器
的名称是____________,D仪器的名称是____________,E仪器的名称是______________。
(2)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥
c.检漏 d.标定
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
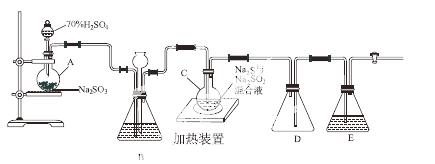
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO 2(g)===3S(s)+2H2O(l) (Ⅱ)
2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)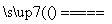 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O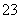 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com