
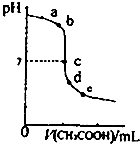
 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |


 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
| A、pH皆等于3 的两种溶液都稀释100倍后,pH都为5 |
| B、10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
| C、在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| D、室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系可能是:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H3AsO4>H2SO4>H3PO4 |
| B、微粒的半径:Cl->Na+>Mg2+>Al3+ |
| C、热稳定性:HF>HCl>HBr>HI |
| D、熔点:SiO2>NaCl>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠的焰色反应(铂丝、氯化钠溶液、稀盐酸) |
| B、蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液) |
| C、硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体) |
| D、肥皂的制取(蒸发皿、玻璃棒、甘油) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 2-乙基丙烷 2-乙基丙烷 |
| B、2-甲基丙烯 (CH3)2C=CH2 |
C、1,3,4-三甲苯  |
| D、2,2-二甲基-3-丁醇 (CH3)3C-CHOH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
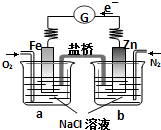
| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+2H2O-4e-═4OH-,溶液pH升高 |
| C、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
| D、烧杯b中发生的电极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA |
| B、常温常压下,16g O3所含的电子数为8NA |
| C、0.1mol Na2O2晶体中含有0.4NA个离子 |
| D、铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀盐再用蒸馏水稀释,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
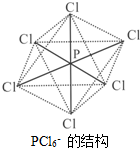 氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com