
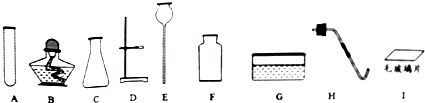
 有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是ABE.
有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是ABE.分析 Y端适合于作入口,可用于洗气、除杂、收集密度比空气密度大的气体,以此来解答.
解答 解:A.瓶内盛液体干燥剂,用以干燥气体,为洗气干燥装置,Y端适合于作入口,故选;
B.瓶内盛液体洗涤剂,用以除去某气体中的杂质,为除杂杂质,Y端适合于作入口,故选;
C.瓶内盛水,用以测量某难溶于水的气体的体积,应将水排出,则短端作气体入口,故不选;
D.瓶内贮存气体,加水时气体可被排出,则短端作气体入口,故不选;
E.收集密度比空气大的气体,Y端适合于作入口,故选;
F.收集密度比空气小的气体,则短端作气体入口,故不选;
故答案为:ABE.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意多用瓶在实验中的应用,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上用过量氨水吸收二氧化硫:NH3+SO2+H2O=NH4++HSO3- | |
| B. | 向氯化亚铁溶液中加入稀硝酸3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| D. | 硝酸铵与热氢氧化钠浓溶液反应:NH4++OH-=NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收471kJ能量 | B. | 放出479kJ能量 | C. | 吸收479kJ能量 | D. | 放出445kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中含有4个C-H共价键 | |
| B. | 甲烷分子中C-H共价键的夹角为109°28' | |
| C. | 甲烷是正四面体结构 | |
| D. | 甲烷是一种直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与溴水(加成反应) | |
| B. | 苯与浓硝酸(取代反应) | |
| C. | 乙醇与乙酸制乙酸乙酯(酯化反应) | |
| D. | 乙醇在铜、银等催化剂存在下与氧气(取代反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加入稀HNO3:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| B. | 碳酸钠溶液显碱性:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 碳酸氢钠溶液中滴入过量澄清石灰水:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种官能团 | |
| B. | 可与乙醇、乙酸、溴水发生反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与2molNaHCO3发生反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com