
| A. | 往紫色石蕊试液中加入盐酸,溶液变红 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
分析 A.盐酸电离出氢离子;
B.铁离子水解生成胶体;
C.白色沉淀为氢氧化亚铁,然后被氧化生成氢氧化铁;
D.二氧化硫与NaOH反应生成盐和水.
解答 解:A.盐酸电离出氢离子溶液显酸性,加石蕊变红,与氧化还原反应无关,故A不选;
B.铁离子水解生成胶体,变成红褐色胶体,与氧化还原反应无关,故B不选;
C.白色沉淀为氢氧化亚铁,然后被氧化生成氢氧化铁,则白色变成灰绿色,最后变成红褐色,与氧化还原反应无关,故C选;
D.二氧化硫与NaOH反应生成盐和水,为复分解反应,氧化还原反应无关,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意现象与反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 放电时储氢合金作正极 | |
| B. | 充电时储氢合金作负极 | |
| C. | 充电时阳极周围c(OH-)减少 | |
| D. | 放电时负极反应为LaNi5H6-6e-═LaNi5+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有5.6 g金属被腐蚀 | B. | 有6.5 g金属被氧化 | ||
| C. | 有0.15 mol金属失去电子 | D. | 标准状况下有4.48 L H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
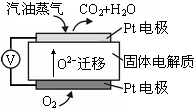 淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
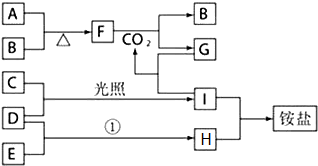 某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.
某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 | |
| B. | 配制稀盐酸定容时,俯视容量瓶刻度线 | |
| C. | 滴定前尖嘴处无气泡,滴定终点时有气泡 | |
| D. | 滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com