
下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来。
(1) NaCl、KCl、NaClO、CaCl2 。
(2) HNO3、NaNO3、NaNO2、N2O5 。
(3) H3PO4、H2SiO3、HCl、H2SO4 。
(4) 浊液、溶液、胶体、水 。
(5) 空气、N2、HCl气体、CO2 。
(6) 铜、金、银、钠 。
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3 B.4
C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,a mol.L-1一元酸HA与b mol.L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a = b B.a > b C.c(A-) = c(Na+) D.c(A-) < c (Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验研究中经常用到定量分析。
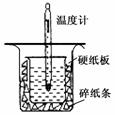 I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
(1)从右图实验装置看,装置中的一个明显错误是
。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值
会_________,(填“偏大”、“偏小”、“ 不变”)
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55 mol·L-1NaOH 溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由 。
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
 请回答:
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致
测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:________________,且半分钟内不变色。
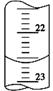
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO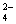 全部转化成BaSO4沉
全部转化成BaSO4沉
淀,此时铝元素的存在形式是
A. Al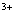 B. Al(OH)3 C. AlO
B. Al(OH)3 C. AlO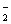 D. Al
D. Al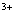 和Al(OH)3
和Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究。
 (1)根据右图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。实验中使用肥皂液检验的产物是 ;图中湿棉花的作用是 ;铁粉与水蒸气反应的化学方程式是 。
(1)根据右图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。实验中使用肥皂液检验的产物是 ;图中湿棉花的作用是 ;铁粉与水蒸气反应的化学方程式是 。
(2)甲同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
(查阅资料可知:Fe3O4 + 8HCl(浓)  FeCl2 + 2FeCl3 + 4H2O)
FeCl2 + 2FeCl3 + 4H2O)
| 实验序号 | 实验操作 | 实验现象 |
| ① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产 生,溶液呈浅绿色。 |
| ② | 向上述烧杯中滴加几滴KSCN溶 液,充分振荡 | 溶液没有出现红色 |
根据上述实验现象,不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是 (填化学式);
(3) 乙同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
| 实验序号 | 实验操作 | 实验现象 |
| ① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
| ② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
| ③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
根据乙同学的实验现象和数据,残留黑色固体中Fe3O4的质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com