
【题目】在标准状况下相同体积的下列气体,其质量最大的是( )
A. N2 B. SO2 C. CO2 D. CH4
科目:高中化学 来源: 题型:
【题目】已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出X kJ热量;单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热ΔH为
A. -Y kJ/mol B. -(5X-0.5Y)kJ/mol
C. -(10X-Y)kJ/mol D. +(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“![]() ”代表一种元素,其中
”代表一种元素,其中![]() 点代表氢元素
点代表氢元素![]() 下列说法不正确的是( )
下列说法不正确的是( )

A. 最高价氧化物对应水化物的酸性![]() 比
比![]() 弱
弱
B. 最简单气态氢化物的稳定性![]() 比
比![]() 小
小
C. 金属性![]() 比
比![]() 弱
弱
D. 原子半径![]() 比
比![]() 大
大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是
A. 往容积一定的容器中再通入O2,可以加快反应2SO2+O2![]() 2SO3的反应速率
2SO3的反应速率
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 对于C(s)+H2O(g)![]() CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示的装置对SO2气体的那分性质进行观察和探究。下对说法中的现象和结论均正确的是
选项 | 试剂 | 现象 | 结论 |
A | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
B | 品红溶液 | 溶液褪色 | SO2有还原性 |
C | 滴有酚酞的NaOH溶液 | 溶液褪色 | SO2有酸性 |
D | 紫色石蕊试液 | 溶液先变红后褪色 | SO2有酸性、有漂白性 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定气体体积的因素:①气体分子的直径、②气体的物质的量多少、③气体分子间的平均距离、④气体分子的相对分子质量,则决定气体体积的因素主要为( )
A. ①②B. ①③C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硝酸银溶液为滴定液,测定能与Ag+反应生成难溶性电解质的一种容量分析方法叫银量法。其原理如下:
①Ag++X-=AgX↓(X-表示Cl-、Br-、I-、CN-、SCN-等离子)——用于定量计算
②2Ag++CrO42-=Ag2CrO4↓(砖红色)——用于指示滴定的終点
[已知: Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=1.12×10-12]。
某氯碱厂为测定饱和食盐水被电解后所得淡盐水(见图)里氯化钠的浓度,采用以上银量法,每次取20.00ml 淡盐水进行滴定,共进行了三次。据此,回答下列问题:

(1)配制100mL 0.4mol/L的硝酸银溶液(标准液)时,需要用托盘天平称取____gAgNO3固体,制成的溶液需置于棕色试剂瓶中(备用),原因是_______________。
(2)为了使溶液中的Cl-恰好沉淀完全(溶液中残余Cl-的浓度是1.0×10-5mol/L),溶液中(CrO42-)的浓度度应为______mol/L,若CrO42-的浓度大于此数值,则测定结果会偏_____(填“高”或“低”)。滴定时,若此时消耗AgNO3溶液25.00mL.( 三次实验的平均值),则淡盐水中氯化钠的浓度是______mol/L。
(3)根据相关离子的性质,滴定时溶液的pH值应控制在6.5~10,pH值太大或太小对实验均有不良影响,pH值太大的不良影响是__________(用离子反应方程式表示)。
(4)AgCl沉淀易吸附Cl-为减少AgC1沉淀对Cl-的吸附,从而减小实验的误差,实验时应采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
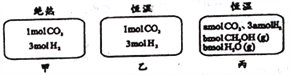
A. 刚开始反应时速率:甲>乙 B. 平衡后反应放热:甲>乙
C. 500℃下该反应平衡常数:K=3×102 D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下事实不能用元素周期律解释的是
A. F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应
B. “NO2球”在冷水中颜色变浅,在热水中颜色加深
C. 氯原子与钠原子形成离子键,与硅原子形成共价键
D. H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com