

 ,
, ;
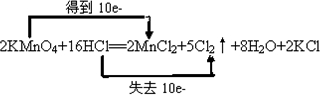
;| 71g |
| 71g/mol |
| 16 |
| 5 |
| 10 |
| 16 |


科目:高中化学 来源: 题型:
| A、用剩的药品不要乱丢,要放回原试剂瓶里 | ||
B、给试管里的液体加热,液体的体积一般不超过试管容积的
| ||
| C、加热后的蒸发皿,要用坩埚钳夹取 | ||
| D、用托盘天平称取5.85gNaCl固体,配制100mL1.00mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应 | a.溶液变红色 |
| 2.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| 3.向新制H2S饱和溶液滴加新制的氯水 | c.反应不十分剧烈,产生的气体能燃烧,溶液变成 浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 4.镁带在空气中燃烧 | d.产生大量气泡、气体可以燃烧 |
| 5.NaI溶液中加入溴水和CCl4 | e.下层溶液变橙色 |
| 6.镁带与沸水反应,再向反应后溶液中滴 加酚酞.镁与2mol/L盐酸反应. | f.浮于水面,熔成小球,迅速向四处游动 |
| 7.蘸浓氨水与浓盐酸的两玻璃棒接近 | g.下层溶液变紫色 |
| 8.NaBr溶液中加入氯水和CCl4 | h.发出耀眼的强光,生成白色物质 |
| 9.铝片与2mol/L盐酸反应 | i.生成淡黄色沉淀 |
| 1、探究同一周期从左到右元素金属性的递变规律 | 2、探究同一主族内从上到下元素非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主食 | 面包 |
| 副食 | 酱牛肉 |
| 饮品 | 豆浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物 |
| B、电离、电解均有化学键的破坏过程,因此均属于化学变化 |
| C、常温下干燥的液氯可以用钢瓶储存,所以任何条件下Cl2与铁都不反应 |
| D、葡萄糖溶液和淀粉溶液的本质区别是能否发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向10mL 0.1mol?L-1的H2C2O4溶液中逐滴加入0.1mol?L-1 KOH溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1的H2C2O4溶液中逐滴加入0.1mol?L-1 KOH溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、KHC2O4溶液呈弱碱性 |
| B、B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-) |
| C、C点时:c(K+)<c(HC2O4- )+2c(C2O42-)+c(H2C2O4) |
| D、D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com