
分析 (1)硝酸银溶液中加入氨水,先生成AgOH沉淀,继续加入氨水,沉淀溶解,生成Ag(NH3)2OH;
(2)葡萄糖中含有醛基,能够与Ag(NH3)2OH发生氧化还原反应生成Ag.
解答 解:(1)硝酸银能和氨水反应生成氢氧化银沉淀,反应的离子方程式是Ag++NH3•H2O=AgOH↓+NH4+,继续滴加至沉淀恰好溶解,即得银氨溶液,反应的离子方程式②为AgOH+2NH3=[Ag(NH3)2]++OH-,故答案为:Ag++NH3•H2O=AgOH↓+NH4+;AgOH+2NH3=[Ag(NH3)2]++OH-;
(2)试管内壁上形成银镜,是醛基与Ag(NH3)2OH发生氧化还原反应生成Ag,则此反应的化学方程式为CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,故答案为:CH2OH(CHOH)4-CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2OH(CHOH)4-COONH4+2Ag↓+3NH3+H2O.
点评 本题考查银氨溶液以及银镜反应,为高频考点,把握物质的性质是解答本题的关键,注意银氨溶液的配制及银镜反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,N2的转化率能达到100% | |
| D. | 达到平衡时,N2、H2和NH3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 用氢氧化钠溶液可以除去乙酸乙酯中混有的乙酸、乙醇杂质 | |
| C. | 化合物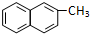 是苯的同系物 是苯的同系物 | |
| D. | 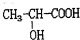 在一定条件下可以发生缩聚反应生成聚合物 在一定条件下可以发生缩聚反应生成聚合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| B. | 常用新制的氢氧化铜检验司机酒后驾车 | |
| C. | 棉花和木材的主要成分都是纤维素 | |
| D. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可得到丙三醇 | B. | 可用碘检验淀粉是否完全水解 | ||
| C. | 蛋白质水解的最终产物为氨基酸 | D. | 纤维素与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
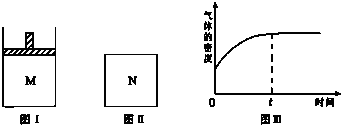
| A. | x=4 | |
| B. | 若N中气体的密度如图Ⅲ所示,则A、B都是气态 | |
| C. | 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等 | |
| D. | 若A、B均为气体,平衡时M中A的转化率大于N中A的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com