
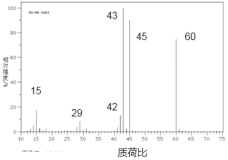
ΓΨΧβΡΩΓΩάν±»œΘ « 19 άΦΆΉν÷χΟϊΚΆΉν”–≥…ΙϊΒΡΜ·―ßΦ“ΓΘΥϊΒΡΙ±œΉ÷°“ΜΨΆ «ΖΔΟςΝΥ»Φ…’Ζ®≤βΕ®”–ΜζΈοΜ·―ßΉι≥…ΓΘ
Δώ.Ρ≥Έο÷ Άξ»Ϊ»Φ…’Κσ…ζ≥…Εΰ―θΜ·ΧΦΚΆΥ°Θ§œ÷»Γ 3.0g ΗΟΈο÷ άϊ”Οάν±»œΘΖ®Ϋχ––Ήι≥…≤βΕ®Θ§ΈόΥ°¬»Μ·ΗΤ‘ω÷Ί 1.8gΘ§≈®«β―θΜ·ΦΊ»ή“Κ‘ω÷Ί 4.4gΘ§‘ρΗΟΈο÷ ΒΡΉνΦρ ΫΈΣ_________________ΘΜ
Δρ.Εύ÷÷Έο÷ ΖϊΚœ¥ΥΉνΦρ ΫΘ§»τ“Σ»ΖΕ®ΨΏΧεΒΡΈο÷ Θ§ΜΙ–ηΗ®÷ζΤδΥϋΒΡ≤βΝΩ ÷ΕΈΓΘ
(1)»τΈο÷ A ΒΡ÷ ΤΉΆΦ»γΆΦΥυ ΨΘΚ
ΔΌ‘ρ A ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ_____________________ΘΜ
ΔΎ»τΫΪ A Φ”»κΒΫΉœ…Ϊ ·»ο ‘“Κ÷–±δΚλΘ§‘ρ A ΒΡΫαΙΙΦρ ΫΈΣ________________ΘΜ
(2)»τ≤βΕ®Έο÷ B ΒΡ’τΤχΟήΕ» «œύΆ§Ή¥Ωωœ¬ H2 ΒΡ 45 ±Ε
ΔΌ‘ρ B ΒΡΖ÷Ή” ΫΈΣ__________________ΘΜ
ΔΎ≤βΕ® B ΒΡΚλΆβΙβΤΉΆΦ”– C=O ΦϋΓΔOΓΣH ΦϋΓΔ≤ΜΕ‘≥ΤΓΣCH2ΓΣΒ»ΒΡ’ώΕ·Έϋ ’ΖεΘ§ΤδΚΥ¥≈Ι≤’ώ«βΤΉ»γΆΦΥυ ΨΘ§B ΒΡΫαΙΙΦρ ΫΈΣ_________________ΘΜ

Δέ»Γ“ΜΕ®ΝΩΒΡBΈο÷ ΤΫΨυΖ÷≥…2ΖίΘ§“ΜΖί”κΉψΝΩΒΡNaHCO3Ής”ΟΘ§“ΜΖί”κΉψΝΩΒΡNaΉς”ΟΘ§‘ρ≤ζ…ζΒΡCO2”κH2ΒΡΧεΜΐ±»ΈΣ___ΘΜ
(3)»τ≤βΕ® C Έο÷ ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ 180Θ§«“ C ΈΣΒμΖέΥ°ΫβΒΡΉν÷’≤ζΈοΘ§≤Δ«“‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§ C Ρή”κ…œ ωΒΡ A Έο÷ ΖΔ…ζ»γœ¬ΉΣΜ·ΙΊœΒΘΚ

ΔΌ«κ–¥≥ω D ±δ≥… E ΒΡΜ·―ßΖΫ≥Χ Ϋ___________________ΘΜ
ΔΎ“―÷Σ G Έο÷ ΈΣ D Έο÷ ΒΡΆ§œΒΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ±» D ¥σ 14Θ§«“ΤδΚΥ¥≈Ι≤’ώHΤΉœ‘ Ψ 3 ΉιΖεΘ§ΟφΜΐ±»ΈΣ 6ΘΚ1ΘΚ1Θ§«κ–¥≥ω G ”κ A ΖΔ…ζθΞΜ·Ζ¥”ΠΒΡΖΫ≥Χ Ϋ____________Θ§
Δσ.Ζ÷±πΫΪΒ»÷ ΝΩΒΡ…œ ωAΓΔBΓΔC»ΐ÷÷Έο÷ ”κΉψΝΩΒΡ―θΤχΖ¥”ΠΘ§ΥϋΟ« ΒΦ œϊΚΡ―θΤχΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ____ΓΘ
ΓΨ¥πΑΗΓΩCH2O 60 CH3COOH C3H6O3 CH2(OH)CH2COOH 1:1 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH(OH)CH3+CH3COOH
2CH3CHO+2H2O CH3CH(OH)CH3+CH3COOH![]() CH3COOCH(CH3)2+ H2O 1:1:1
CH3COOCH(CH3)2+ H2O 1:1:1
ΓΨΫβΈωΓΩ
Δώ.ΗυΨίΗΟΈο÷ »Φ…’…ζ≥…ΒΡΕΰ―θΜ·ΧΦΚΆΥ°ΒΡ÷ ΝΩΖ÷±πΦΤΥψCΓΔH‘ΣΥΊΒΡΈο÷ ΒΡΝΩΓΔ÷ ΝΩΘ§‘ΌΫαΚœΗΟΈο÷ ΒΡ÷ ΝΩ≈–Εœ”–ΈόO‘ΣΥΊΘ§ΦΑΤδΈο÷ ΒΡΝΩΘ§¥”Εχ»ΖΕ®ΉνΦρ ΫΘΜ
Δρ.(1)ΔΎ”…A ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΦΑΉνΦρ Ϋ»ΖΕ®Ζ÷Ή” ΫΘ§‘ΌΗυΨίΤδ–‘÷ »ΖΕ®ΤδΫαΙΙΦρ ΫΘΜ
(2)ΔΌΗυΨίΑΔΖϋΦ”Β¬¬όΕ®¬…ΒΡΆΤ¬έ»ΖΕ®BΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΘ§‘ΌΫαΚœΉνΦρ Ϋ»ΖΕ®Ζ÷Ή” ΫΘΜ
ΔΎΗυΨίBΒΡΚλΆβΙβΤΉΆΦ»ΖΕ®ΒΡΜ·―ßΦϋΜρΙΌΡήΆ≈–≈œΔ“‘ΦΑΤδΚΥ¥≈Ι≤’ώ«βΤΉ»ΖΕ®BΒΡΫαΙΙΦρ ΫΘΜ
ΔέΗυΨίCH2(OH)CH2COOHΖ÷±π”κNaHCO3ΚΆNaΖ¥”ΠΒΡΧΊΒψΫχ––Ζ÷ΈωΘΜ
(3)ΗυΨίCΈο÷ ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΚΆΉνΦρ Ϋ»ΖΕ®Ζ÷Ή” ΫΘ§‘ΌΗυΨίCΈΣΒμΖέΥ°ΫβΒΡΉν÷’≤ζΈοΘ§»ΖΕ®CΈΣΤœΧ―Χ«Θ§ΤœΧ―Χ«‘ΎΨΤΜ·ΟΗΒΡΉς”Οœ¬…ζ≥…DΈΣ““¥ΦCH3CH2OHΘ§““¥ΦΖΔ…ζ¥ΏΜ·―θΜ·…ζ≥…EΈΣ““»©CH3CHOΘ§““»©ΦΧ–χ±Μ―θΜ·…ζ≥…AΈΣ““ΥαCH3COOHΘ§““¥ΦΚΆ““ΥαΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…FΈΣ““Υα““θΞCH3COOCH2CH3Θ§Ψί¥ΥΖ÷ΈωΫβ¥πΘΜ
Δσ.ΉνΦρ ΫœύΆ§ΒΡ”–ΜζΈο÷ ΝΩœύΒ»Θ§Άξ»Ϊ»Φ…’ΚΡ―θΝΩœύΒ»ΓΘ
Δώ.Ρ≥Έο÷ Άξ»Ϊ»Φ…’Κσ…ζ≥…Εΰ―θΜ·ΧΦΚΆΥ°Θ§ΗΟΈο÷ ÷–“ΜΕ®Κ§”–CΓΔH‘ΣΥΊΘ§Ω…ΡήΚ§”–O‘ΣΥΊΘ§œ÷»Γ 3.0g ΗΟΈο÷ άϊ”Οάν±»œΘΖ®Ϋχ––Ήι≥…≤βΕ®Θ§ΈόΥ°¬»Μ·ΗΤ‘ω÷Ί 1.8gΘ§‘ρ![]() Θ§n(H)=0.2molΘ§m(H)=0.2gΘ§”÷≈®«β―θΜ·ΦΊ»ή“Κ‘ω÷Ί4.4gΘ§‘ρ
Θ§n(H)=0.2molΘ§m(H)=0.2gΘ§”÷≈®«β―θΜ·ΦΊ»ή“Κ‘ω÷Ί4.4gΘ§‘ρ![]() Θ§n(C)=0.1molΘ§m(C)=1.2gΘ§‘ρm(O)=3.0g- m(H)- m(C)=3.0g-0.2g-1.2g=1.6gΘ§
Θ§n(C)=0.1molΘ§m(C)=1.2gΘ§‘ρm(O)=3.0g- m(H)- m(C)=3.0g-0.2g-1.2g=1.6gΘ§![]() Θ§Ι n(C)ΘΚn(H)ΘΚn(O)=0.1molΘΚ0.2molΘΚ0.1mol=1:2:1Θ§‘ρΗΟΈο÷ ΒΡΉνΦρ ΫΈΣCH2OΘΜ
Θ§Ι n(C)ΘΚn(H)ΘΚn(O)=0.1molΘΚ0.2molΘΚ0.1mol=1:2:1Θ§‘ρΗΟΈο÷ ΒΡΉνΦρ ΫΈΣCH2OΘΜ
Δρ.(1)ΔΌ”…Έο÷ A ΒΡ÷ ΤΉΆΦΩ…÷Σ A ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ60ΘΜ
ΔΎA ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ60Θ§ΉνΦρ ΫΈΣCH2O( ΫΝΩΈΣ30)Θ§‘ρΖ÷Ή” ΫΈΣC2H4O2Θ§»τΫΪ A Φ”»κΒΫΉœ…Ϊ ·»ο ‘“Κ÷–±δΚλΘ§‘ρA÷–Κ§”–τ»ΜυΘ§A”ΠΈΣ““ΥαΘ§‘ρ A ΒΡΫαΙΙΦρ ΫΈΣCH3COOHΘΜ
(2)ΔΌ”…Ά§Έ¬Ά§―Ιœ¬Θ§ΤχΧεΒΡΟήΕ»÷°±»Β»”ΎΤδΡΠΕϊ÷ ΝΩ÷°±»Ω…÷ΣΘ§»τ≤βΕ®Έο÷ B ΒΡ’τΤχΟήΕ» «œύΆ§Ή¥Ωωœ¬ H2 ΒΡ 45 ±ΕΘ§‘ρBΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ90Θ§ΉνΦρ ΫΈΣCH2OΘ§‘ρΖ÷Ή” ΫΈΣC3H6O3ΘΜ
ΔΎ≤βΕ® B ΒΡΚλΆβΙβΤΉΆΦ”– C=O ΦϋΓΔOΓΣH ΦϋΓΔ≤ΜΕ‘≥ΤΓΣCH2ΓΣΒ»ΒΡ’ώΕ·Έϋ ’ΖεΘ§”…ΤδΚΥ¥≈Ι≤’ώ«βΤΉΩ…÷ΣΘ§B÷–Κ§”–4÷÷Β»–ß«β‘≠Ή”Θ§«“Ηω ΐ±»ΈΣ2:2:1:1Θ§Ι BΒΡΫαΙΙΦρ ΫΈΣCH2(OH)CH2COOHΘΜ
ΔέCH2(OH)CH2COOH÷–τ»ΜυΩ…“‘”κNaHCO3Ζ¥”Π…ζ≥…CO2Θ§«“ΖϊΚœΙΊœΒ ΫCH2(OH)CH2COOH~CO2Θ§τ«ΜυΚΆτ»ΜυΨυΩ…“‘”κNaΖ¥”Π…ζ≥…«βΤχΘ§«“ΖϊΚœΙΊœΒ ΫCH2(OH)CH2COOH~H2Θ§Ι »Γ“ΜΕ®ΝΩΒΡBΈο÷ ΤΫΨυΖ÷≥…2ΖίΘ§“ΜΖί”κΉψΝΩΒΡNaHCO3Ής”ΟΘ§“ΜΖί”κΉψΝΩΒΡNaΉς”ΟΘ§≤ζ…ζΒΡCO2”κH2ΒΡΧεΜΐ±»ΈΣ1:1ΘΜ
(3)»τ≤βΕ® C Έο÷ ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ180Θ§ΉνΦρ ΫΈΣCH2OΘ§‘ρΖ÷Ή” ΫΈΣC6H12O6Θ§«“ C ΈΣΒμΖέΥ°ΫβΒΡΉν÷’≤ζΈοΘ§‘ρCΈΣΤœΧ―Χ«Θ§ΤœΧ―Χ«‘ΎΨΤΜ·ΟΗΒΡΉς”Οœ¬…ζ≥…DΈΣ““¥ΦCH3CH2OHΘ§““¥ΦΖΔ…ζ¥ΏΜ·―θΜ·…ζ≥…EΈΣ““»©CH3CHOΘ§““»©ΦΧ–χ±Μ―θΜ·…ζ≥…AΈΣ““ΥαCH3COOHΘ§““¥ΦΚΆ““ΥαΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…FΈΣ““Υα““θΞCH3COOCH2CH3Θ§
ΔΌ““¥ΦΖΔ…ζ¥ΏΜ·―θΜ·…ζ≥…““»©Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2CH3CH2OH+O2![]() 2CH3CHO+2H2OΘΜ
2CH3CHO+2H2OΘΜ
ΔΎ“―÷Σ G Έο÷ ΈΣ D Έο÷ ΒΡΆ§œΒΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ±» D ¥σ 14Θ§‘ρGΈΣ±ϊ¥ΦΘ§«“ΤδΚΥ¥≈Ι≤’ώHΤΉœ‘ Ψ 3 ΉιΖεΘ§ΟφΜΐ±»ΈΣ 6ΘΚ1ΘΚ1Θ§‘ρGΈΣ2-±ϊ¥ΦΘ§ΫαΙΙΦρ ΫΈΣCH3CH(OH)CH3Θ§Τδ”κCH3COOHΖΔ…ζθΞΜ·Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣCH3CH(OH)CH3+CH3COOH![]() CH3COOCH(CH3)2+ H2OΘΜ
CH3COOCH(CH3)2+ H2OΘΜ
Δσ.“ρΈΣAΓΔBΓΔCΒΡΉνΦρ ΫœύΆ§Θ§‘ρΒ»÷ ΝΩΒΡAΓΔBΓΔCΥυΚ§”–ΒΡCΓΔHΓΔO‘ΣΥΊΒΡ÷ ΝΩœύΒ»Θ§‘ρΖ÷±πΫΪΒ»÷ ΝΩΒΡ…œ ωAΓΔBΓΔC»ΐ÷÷Έο÷ ”κΉψΝΩΒΡ―θΤχΖ¥”ΠΘ§ΥϋΟ« ΒΦ œϊΚΡ―θΤχΒΡΈο÷ ΒΡΝΩœύΒ»Θ§Φ¥±»÷ΒΈΣ1:1:1ΓΘ


 ”≈…ζά÷‘ΑœΒΝ–¥πΑΗ
”≈…ζά÷‘ΑœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩM « ·”ΆΝ―ΫβΤχΒΡ÷Ί“Σ≥…Ζ÷Θ§”…M÷Τ±ΗΜΖθΞPΒΡΚœ≥…¬ΖœΏ(≤ΩΖ÷Ζ¥”ΠΧθΦ଑»Ξ)»γΆΦΥυ ΨΘΚ

“―÷Σ‘ΎΧΊ β¥ΏΜ·ΦΝΒΡΉς”Οœ¬Θ§ΡήΙΜΖΔ…ζΧΦΧΦΥΪΦϋΝΫ±ΏΜυΆ≈ΜΞΜΜΒΡΖ¥”ΠΘ§»γ:
2CH2=CHR![]() CH2=CH2+RCH=CHR
CH2=CH2+RCH=CHR
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)MΒΡΟϊ≥Τ «____________Θ§A÷–ΒΡΚ§―θΙΌΡήΆ≈Οϊ≥Τ «____________ΓΘ
(2)ΔΌΒΡΖ¥”Πάύ–Ά «___________Θ§ΔόΒΡΖ¥”Πάύ–Ά «________________ΓΘ
(3)CΒΡΫαΙΙΦρ ΫΈΣ____________ΓΘ”…CΓζGΒΡΙΐ≥Χ÷–≤Ϋ÷ηΔήΓΔΔόΒΡΡΩΒΡ «___________ΓΘ
(4)G÷–ΉνΕύ”–_______Ηω‘≠Ή”Ι≤ΤΫΟφΘ§ΤδΥ≥ ΫΫαΙΙ ΫΈΣ_____________ΓΘ
(5)ΖϊΚœœ¬Ν–ΧθΦΰDΒΡΆ§Ζ÷“λΙΙΧε”–______÷÷ΓΘ
ΔΌ¬»‘≠Ή”Ν§‘ΎΧΦΝ¥ΒΡΕΥΒψΧΦ…œ ΔΎτ«ΜυΝ§‘Ύ≤ΜΆ§ΒΡΧΦ‘≠Ή”…œΘ§Τδ÷–ΚΥ¥≈Ι≤’ώ«βΤΉΈΣ4ΉιΖε«“ΖεΟφΜΐ±»ΈΣ4ΘΚ2ΘΚ2ΘΚ1ΒΡΈΣ__________(–¥ΫαΙΙΦρ Ϋ)ΓΘ
(6)”…IΚΆG‘Ύ“ΜΕ®ΧθΦΰœ¬÷Τ»ΓΜΖθΞPΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_________________ΓΘ
(7)“―÷ΣΘΚ  ΗυΨίΧβ÷––≈œΔΘ§…ηΦΤ“‘2-¬»±ϊΆι÷Τ±ΗΜΖΦΚœ©ΒΡΚœ≥…¬ΖœΏ(ΈόΜζ ‘ΦΝΚΆ»ήΦΝ»Έ―Γ)___________ΓΘ
ΗυΨίΧβ÷––≈œΔΘ§…ηΦΤ“‘2-¬»±ϊΆι÷Τ±ΗΜΖΦΚœ©ΒΡΚœ≥…¬ΖœΏ(ΈόΜζ ‘ΦΝΚΆ»ήΦΝ»Έ―Γ)___________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈόΥ°MgBr2Ω…”ΟΉς¥ΏΜ·ΦΝΘ° Β―ι “≤…”ΟΟΨ–Φ”κ“ΚδεΈΣ‘≠Νœ÷Τ±ΗΈόΥ°MgBr2Θ§ΉΑ÷Ο»γΆΦ1Θ§÷ς“Σ≤Ϋ÷η»γœ¬ΘΚ

≤Ϋ÷η1 »ΐΨ±ΤΩ÷–ΉΑ»κ10gΟΨ–ΦΚΆ150mLΈόΥ°““Ο―ΘΜΉΑ÷ΟB÷–Φ”»κ15mL“ΚδεΘ°
≤Ϋ÷η2 ΜΚ¬ΐΆ®»κΗ…‘οΒΡΒΣΤχΘ§÷±÷ΝδεΆξ»ΪΒΦ»κ»ΐΨ±ΤΩ÷–Θ°
≤Ϋ÷η3 Ζ¥”ΠΆξ±œΚσΜ÷Η¥÷Ν≥ΘΈ¬Θ§Ιΐ¬ΥΘ§¬Υ“ΚΉΣ“Τ÷ΝΝμ“ΜΗ…‘οΒΡ…’ΤΩ÷–Θ§ά以÷Ν0ΓφΘ§Έω≥ωΨßΧεΘ§‘ΌΙΐ¬ΥΒΟ»ΐ““Ο―δεΜ·ΟΨ¥÷ΤΖΘ°
≤Ϋ÷η4 “Έ¬œ¬”Ο±Ϋ»ήΫβ¥÷ΤΖΘ§ά以÷Ν0ΓφΘ§Έω≥ωΨßΧεΘ§Ιΐ¬ΥΘ§œ¥Β”ΒΟ»ΐ““Ο―ΚœδεΜ·ΟΨΘ§Φ”»»÷Ν160ΓφΖ÷ΫβΒΟΈόΥ°MgBr2≤ζΤΖΘ°
“―÷ΣΘΚΔΌMg”κBr2Ζ¥”ΠΨγΝ“Ζ≈»»ΘΜMgBr2ΨΏ”–«ΩΈϋΥ°–‘Θ°
ΔΎMgBr2+3C2H5OC2H5MgBr23C2H5OC2H5
«κΜΊ¥πΘΚ
Θ®1Θ©“«ΤςAΒΡΟϊ≥Τ «______Θ° Β―ι÷–≤ΜΡή”ΟΗ…‘οΩ’Τχ¥ζΧφΗ…‘οN2Θ§‘≠“ρ «______________
Θ®2Θ©»γΫΪΉΑ÷ΟBΗΡΈΣΉΑ÷ΟCΘ®ΆΦ2Θ©Θ§Ω…ΡήΜαΒΦ÷¬ΒΡΚσΙϊ «___________________
Θ®3Θ©≤Ϋ÷η3÷–Θ§ΒΎ“Μ¥ΈΙΐ¬Υ≥ΐ»ΞΒΡΈο÷ «_________________Θ°
Θ®4Θ©”–ΙΊ≤Ϋ÷η4ΒΡΥΒΖ®Θ§’ΐ»ΖΒΡ «__________________Θ°
AΓΔΩ…”Ο95%ΒΡ““¥Φ¥ζΧφ±Ϋ»ήΫβ¥÷ΤΖ
BΓΔœ¥Β”ΨßΧεΩ…―Γ”Ο0ΓφΒΡ±Ϋ
CΓΔΦ”»»÷Ν160ΓφΒΡ÷ς“ΣΡΩΒΡ «≥ΐ»Ξ±Ϋ
DΓΔΗΟ≤Ϋ÷ηΒΡΡΩΒΡ «≥ΐ»Ξ““Ο―ΚΆΩ…Ρή≤–ΝτΒΡδε
Θ®5Θ©ΈΣ≤βΕ®≤ζΤΖΒΡ¥ΩΕ»Θ§Ω…”ΟEDTAΘ®Φρ–¥ΈΣYΘ©±ξΉΦ»ή“ΚΒΈΕ®Θ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚMg2++Y4©¹®TMgY2©¹ΔΌΒΈΕ®Ιήœ¥Β”«ΑΒΡ≤ΌΉς «_____________________________Θ°
ΔΎ≤βΕ® ±Θ§œ»≥Τ»Γ0.2500gΈόΥ°MgBr2≤ζΤΖΘ§»ήΫβΚσΘ§”Ο0.0500molL©¹1ΒΡEDTA±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§œϊΚΡEDTA±ξΉΦ»ή“Κ25.00mLΘ§‘ρ≤βΒΟΈόΥ°MgBr2≤ζΤΖΒΡ¥ΩΕ» «__________________Θ®“‘÷ ΝΩΖ÷ ΐ±μ ΨΘ©Θ°
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“Μ÷÷”Ο”Ύ«ΐΕ·«±ΆßΒΡ“ΚΑ±![]() “Κ―θ»ΦΝœΒγ≥Ί‘≠άμ Ψ“β»γΆΦΘ§œ¬Ν–”–ΙΊΗΟΒγ≥ΊΥΒΖ®’ΐ»ΖΒΡ «
“Κ―θ»ΦΝœΒγ≥Ί‘≠άμ Ψ“β»γΆΦΘ§œ¬Ν–”–ΙΊΗΟΒγ≥ΊΥΒΖ®’ΐ»ΖΒΡ «

A.ΗΟΒγ≥ΊΙΛΉς ±Θ§ΟΩœϊΚΡ22.4LNH3ΉΣ“Τ3molΒγΉ”
B.ΒγΉ””…ΒγΦΪAΨ≠ΆβΒγ¬ΖΝςœρΒγΦΪB
C.Βγ≥ΊΙΛΉς ±Θ§OH-œρΒγΦΪB“ΤΕ·
D.ΒγΦΪB…œΖΔ…ζΒΡΒγΦΪΖ¥”ΠΈΣΘΚ ![]() H2O
H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A.1molΧζ‘Ύ1molCl2÷–»Φ…’Θ§Ήν÷’ΉΣ“ΤΒΡΒγΉ” ΐΈΣ2NA
B.50g÷ ΝΩΖ÷ ΐΈΣ46%ΒΡ““¥ΦΥ°»ή“Κ÷–Κ§”–ΒΡ«β‘≠Ή”Ήή ΐΈΣ6NA
C.1mol–έΜΤ(÷ς“Σ≥…Ζ÷ΈΣAs4S4,ΫαΙΙΈΣ ÷–Κ§”–8NAΗωS-AsΦϋ
÷–Κ§”–8NAΗωS-AsΦϋ
D.±ξΉΦΉ¥Ωωœ¬Θ§22.4LCHCl3÷–Κ§”–¬»‘≠Ή”ΒΡ ΐΡΩΈΣ3NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν– Β―ι≤ΌΉςΡή¥οΒΫ Β―ιΡΩΒΡΒΡ «
―Γœν | Β―ιΡΩΒΡ | Β―ι≤ΌΉς |
A | ≥ΐ»ΞNaHCO3ΙΧΧε÷–Μλ”–ΒΡNH4HCO3 | ÷±Ϋ”ΫΪΙΧΧεΦ”»» |
B | Β―ι “ ’Φ·NO2ΤχΧε | ”Ο≈≈Υ°Φ·ΤχΖ® ’Φ· |
C | Φλ―ιΖ«Ϋπ τ–‘Cl>C | ‘ΎNa2CO3»ή“Κ÷–Φ”»κΉψΝΩHCl |
D | Φλ―ιΡ≥»ή“Κ÷– «Ζώ”– | »ΓΗΟ»ή“Κ”Ύ ‘Ιή÷–Θ§Φ”»κNaOH»ή“ΚΚσΦ”»»Θ§”Ο Σ»σΒΡΚλ…Ϊ ·»ο ‘÷ΫΦλ―ι |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“‘ΝρΥαΙΛ“Β≤ζ…ζΒΡSO2Έ≤ΤχΚΆΑ±Υ°ΓΔ ·Μ“ ·ΓΔΫΙΧΩΓΔΧΦΥα«βοßΈΣ‘≠ΝœΩ…“‘Κœ≥…ΝρΜ·ΗΤΓΔΝρΥαοßΓΔ―«ΝρΥαοßΒ»Έο÷ Θ§…ζ≤ζΝς≥Χ»γœ¬ΘΚ
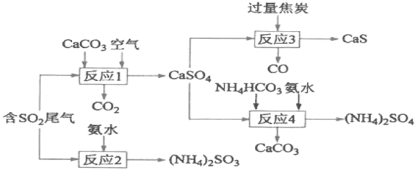
(1)Ζ¥”Π1ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________ΘΜ
(2)Ζ¥”Π2÷–”ΟΉψΝΩΑ±Υ°Έϋ ’SO2Θ§ΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________________ΘΜ
(3)ΈΣ≥δΖ÷άϊ”ΟΗ±≤ζΤΖCOΘ§”–»ΥΧα≥ω“‘»έ»ΎK2CO3ΈΣΒγΫβ÷ Θ§…ηΦΤ≥…CO»ΦΝœΒγ≥Ί“‘Φθ…ΌΕ‘ΜΖΨ≥ΒΡΈέ»ΨΓΘΗΟ»ΦΝœΒγ≥ΊΗΚΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ______________ΘΜ
(4)’ϊΗωΚœ≥…¬ΖœΏ÷–Ω…“‘―≠ΜΖάϊ”ΟΒΡΈο÷ «_____________ΘΜ
(5)(NH4)2SO3»ή“ΚΩ…”Ο”ΎΒγ≥ß≤ζ…ζΒΡ―ΧΒάΤχΒΡΆ―ΒΣΘ§ΫΪΒΣ―θΜ·ΈοΉΣΜ·ΈΣΒΣΤχΘ§Ά§ ±…ζ≥…“Μ÷÷ΒΣΖ Θ§ –Έ≥…Ι≤…ζœΒΆ≥ΓΘΦΤΥψ10.00L 2.00mol/LΒΡ(NH4)2SO3»ή“ΚΩ…“‘¥Πάμ±ξΉΦΉ¥Ωωœ¬NOΤχΧεΒΡΧεΜΐ(–¥≥ωΦΤΥψΙΐ≥Χ)_______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»ΪΙΧΧ§ο°άκΉ”Βγ≥ΊΘ§Ζ≈Βγ ±Βγ≥ΊΖ¥”ΠΈΣ2LiΘΪMgH2ΘΫMgΘΪ2LiHΘ§ΉΑ÷Ο»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «ΘΚ
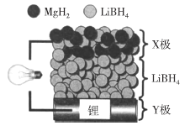
A.Ζ≈Βγ ±Θ§Μ·―ßΡή÷ΜΉΣΜ·ΈΣΒγΡήB.Ζ≈Βγ ±Θ§XΦΪΒΡΖ¥”Π ΫΈΣMgH2ΘΪ2eΘ≠ΘΫMgΘΪ2HΘ≠
C.≥δΒγ ±Θ§LiΘΪœρYΦΪ«®“ΤD.≥δΒγ ±Θ§άμ¬έ…œΉΣ“Τ0.2NAΗωΒγΉ”YΦΪ‘ω÷Ί1.4g
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΣΥΊ÷ήΤΎ±μ”κ‘ΣΥΊ÷ήΤΎ¬…‘Ύ―ßœΑΓΔ―–ΨΩΚΆ…ζ≤ζ ΒΦυ÷–”–÷Ί“ΣΒΡΉς”ΟΓΘœ¬±μΝ–≥ωΔΌΔβ °÷÷‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΓΘ
ΔώA | ΔρA | ΔσA | ΔτA | ΔθA | ΔωA | ΔςA | 0 | |
2 | Δί | Δύ | ||||||
3 | ΔΌ | Δέ | Δή | Δό | Δα | |||
4 | ΔΎ | ΔΏ | Δβ |
(1)ΔΌ~Δβ÷–Ϋπ τ–‘Ήν«ΩΒΡ‘ΣΥΊΈΣ____________(–¥Οϊ≥ΤΘ©ΓΘ
(2)ΔΌΓΔΔύΝΫ÷÷‘ΣΥΊ–Έ≥…ΒΡΜ·ΚœΈοΘ§‘ΎΗΏΈ¬œ¬ΉΤ…’Θ§Μπ―φ≥ ____________…ΪΓΘ
(3)ΔΏΓΔΔαΝΫ÷÷‘ΣΥΊΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΒΡΥα–‘Ϋœ«ΩΒΡ «____________(ΧνΜ·―ß ΫΘ©ΓΘ
(4)ΔΌΓΔΔόΓΔΔύΓΔΔαΥΡ÷÷‘ΣΥΊ–Έ≥…ΒΡΦρΒΞάκΉ”ΑκΨΕ”…¥σΒΫ–ΓΒΡΥ≥–ρ“ά¥Έ «____________span>ΓΘΘ®”ΟΈΔΝΘΖϊΚ≈ά¥±μ ΨΘ©
(5)Δί‘ΣΥΊΒΡ«βΜ·Έο Β―ι “÷ΤΖ®ΒΡΜ·―ßΖΫ≥Χ Ϋ «____________ΓΘ
(6)ΔίΓΔΔαΒΡΤχΧ§«βΜ·Έο‘ΎΩ’Τχ÷–œύ”ω”–ΑΉ―Χ…ζ≥…Θ§–¥≥ωΑΉ―ΧΕ‘”ΠΈο÷ ΒΡΒγΉ” Ϋ____________ΓΘ
(7)œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «____________(ΧνΉ÷ΡΗΘ©ΓΘ
aΘ°ΔόΒΡΖ«Ϋπ τ–‘«Ω”ΎΔΏ bΘ°«βΜ·ΈοΈ»Ε®–‘ΘΚΔΏΘΦΔβ cΘ°ΔέΒΞ÷ ”κΥ°Ζ¥”Π±»ΒΞ÷ ΔΌΨγΝ“
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com