
【题目】下列关于范德华力的叙述正确的是( )
A. 是一种较弱的化学键 B. 分子间存在的较强的电性作用
C. 直接影响物质的熔、沸点 D. 稀有气体的原子间存在范德华力
科目:高中化学 来源: 题型:
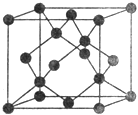
【题目】【化学—选修3:物质结构与性质】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是__________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为 _;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图。有关柠檬烯的分析正确的是
![]()
A.它的一氯代物有 6 种
B.它和丁基苯(C6H5-C4H9)互为同分异构体
C.它的分子中所有的碳原子一定在同一个平面上
D.一定条件下,它分别可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①液态氧;②氢氧化铁胶体;③食盐水;④碳酸钠;⑤氢氧化钾;⑥空气,对上述物质的分类全部正确的是( )
A.盐﹣﹣③④
B.纯净物﹣﹣④⑤⑥
C.碱﹣﹣④⑤
D.混合物﹣﹣②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.Na2SO4=Na2++SO42﹣
B.MgCl2=Mg2++Cl﹣
C.HNO3=H++3NO﹣
D.Ba(OH)2=Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。

(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO![]() 。SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因是 ;Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
。SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因是 ;Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为________________。(忽略过程中溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两组同学利用如下两反应(K为25℃时的平衡常数)设计成原电池(装置如图)。
① AsO43—+2I-+2H+![]() AsO33-+I2+H2O K1=14.2
AsO33-+I2+H2O K1=14.2
② 2Fe3++2I-![]() 2Fe2++I2 K2=1.1×108
2Fe2++I2 K2=1.1×108
左池溶液都相同(KI-I2溶液),右池溶液不同:甲组为Na3AsO4和Na3AsO3的混合溶液,乙组为FeCl3和FeCl2的混合溶液。

当电流表指针指向零点后再改变右池的条件,改变的条件及电流表指针偏转情况记录如下:
操作 | 电流表指针偏转情况 | |
甲组 | 若滴加浓盐酸 | 偏向左方 |
若滴加浓NaOH溶液 | 偏向右方 | |
乙组 | 若滴加浓FeCl2溶液 | 不偏转 |
若滴加浓FeCl3溶液 | 偏向左方 |
则下列叙述错误的是( )
A.同温同浓度时,氧化性:Fe3+>AsO43—
B.与反应②比较,反应①平衡常数小,可逆程度大
C.左池中滴加淀粉溶液变蓝色,再加入足量FeCl2固体,蓝色会褪去
D.甲组在右池加入浓NaOH溶液,此时石墨Ⅱ为负极,AsO33—被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用流程如下:

(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)已知1mol石墨完全转化为金刚石需要吸收1.9kJ的能量。请写出石墨转化为金刚石的热化学反应方程式: _________________________。
(2)①向反应器中通入Cl2前,需通一段时间的N2。高温反应后,石墨中的氧化物杂质均转变为相应氯化物。80℃冷凝的目的是:_____________________。②由活性炭得到气体Ⅱ的化学反应方程式为:_____________________。
(3)加入过量NaOH溶液得到溶液IV的离子反应方程式为:_________________________。
(4)用化学反应原理解释得到沉淀V的过程中乙酸乙酯和加热的作用:________。1kg初级石墨最多可获得V的质量为_______________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com