
【题目】NaOH是一种重要的化学试剂,其摩尔质量为( )
A.20g
B.20gmol﹣1
C.40molg﹣1
D.40gmol﹣1 L
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)D在周期表中的位置___________;
(2)元素C、D、E形成的原子半径大小关系是______________(用元素符号表示)。
(3)C、D可形成化合物D2C2,D2C2含有的化学键类型有______________________;
(4)A、C两种元素形成的原子个数之比为1:1的化合物电子式________________;
(5)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+
B.尼泊金酸( ![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应: ![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH﹣ ![]() CH3COO﹣+NH4++2Ag↓+3NH3+H2O
CH3COO﹣+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,该溶液中可以大量共存的离子组是( )
A. K+、Na+、HCO![]() 、NO
、NO![]() B. Na+、SO
B. Na+、SO![]() 、Cl-、S2-
、Cl-、S2-
C. NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]() D. K+、Ca2+、Cl-、Na+
D. K+、Ca2+、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 molL-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )

A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞船高速进入大气层后,温度会迅速升高,其表层的复合材料可保护飞船不受破坏。这体现了该复合材料具有的特点是
A. 耐酸性 B. 耐热性 C. 耐腐蚀 D. 耐碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学因腹泻引起身体严重缺水,医生除对其进行药物治疗外还考虑补液,下列补液方法最合理的是( )
A.喝葡萄糖水B.喝鲜橙汁
C.输生理盐水D.输蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化碳和氢气在一定条件下可以合成甲醇,其制备反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) 。下列说法正确的是:
CH3OH(g)+H2O(g) 。下列说法正确的是:
A. 调控反应条件不能改变反应限度
B. 化学反应的限度决定了反应物在该条件下的最大转化率
C. 当CO2的消耗速率等于其生成速率时,该反应已停止
D. 投入3molH2能得到1mol的CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体。该晶体以浓氨水、双氧水、CoCl26H2O、NH4Cl 为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
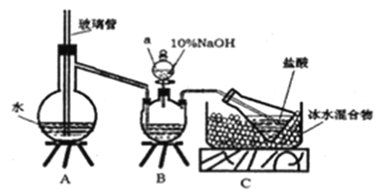
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三预瓶中,然后逐滴加入足量10%NaOH溶液,通入 水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol /L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
步骤二,氯的测定: 准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)装置B中仪器a的名称为_______。
(2)裝置A、B 三脚架处应放置一个酒精灯作为热源,酒精灯应放置在___(填“A”或“B”) 处。
(3) 步骤一所称取的样品中含氮的质量为_______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将____ (填“偏高”、“偏低”或“无影响”); 冰水混合物的作用是________。
(5) 测定氯的过程中,使用棕色滴定管的原因是_______; 出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______ (呈现计算过程)。已知: Ksp(Ag2CrO4)=1.0×10-12 Kp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钻、氮、氯的物质的量之比为1: 6: 3,其中氮元素以氨的形式存在。制备M的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com