
A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等。
请用化学用语回答下列问题:
(1)E元素在周期表中的位置为____________,请写出E最高价氧化物对应水化物的电离方程式:_________________________________。
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为_____>_____>_____; 由A、B、C三种元素组成的18电子微粒的分子式为______________________。
(3)用电子式表示BC2的形成过程:_________________________________。
(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1 mol该分子在一定条件下可以还原4 mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水。请写出化学方程式:_________________________________。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:_________________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是____________L。
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A |
| 升高温度,平衡常数减小 |
| B |
| 0~3 s内,反应速率为v(NO2)= 0.2 mol·L-1 |
| C |
| t1时仅加入催化剂,平衡正向移动 |
| D |
| 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,n(Z)<0.24 mol
D.其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B.标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
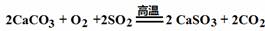
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
合金比纯金属制成的金属材料的优点是 ( )。
①合金的硬度一般比它的各成分金属的大 ②一般地,合金的熔点比它的各成分金属的更低 ③改变原料的配比、改变生成合金的条件,得到有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
要除去铜屑中的少量铁屑。某同学设计了以下两个实验方案:
①加适量CuSO4溶液搅拌过滤—→洗涤
②加适量稀H2SO4溶液搅拌过滤—→洗涤
(1)写出两个实验方案中有关反应的离子方程式:
①__________________________________________________;
②__________________________________________________。
(2)以上两个实验方案中,你愿意选择的是_________________________________。
理由是__________________________________________________
__________________________________________________。
(3)你是否有更简便的方法?写出你的做法。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )。
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com