
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
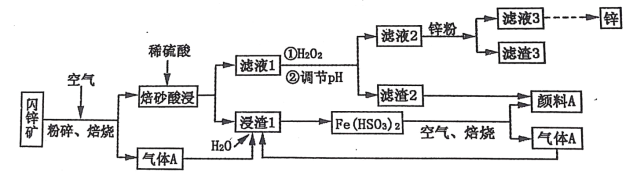
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
【答案】增大固体不氧气的接触面积,提高反应速率。 将Fe2+完全氧化成Fe3+,避免引入杂质 3 Zn和Cu或者Cu 取少量固体A于试管中,加入稀硫酸完全溶解后,滴加酸性KMnO4紫红色褪色,则含有Fe2+ 4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4
【解析】
(1)闪锌矿粉碎的目的是增大固体不氧气的接触面积,提高反应速率。
(2)“滤液 1”中选用足量的 H2O2,理由是将 Fe2+完全氧化成 Fe3+,避免引入杂质。假设“②调节 pH前,滤液1中 c(Fe3+)=1molL-1 ,则Fe3+完全沉淀时,![]() ,
,![]() ,
,![]() ,pH = 3。
,pH = 3。
(3)由于滤液2中加入锌粉,其主要是将铜离子置换出来,锌可能可能,因此“滤渣3”的成分为Zn和Cu或者Cu。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案,主要将固体A溶于稀硫酸中,再用酸性高锰酸钾来验证亚铁离子。
(5)气体A为二氧化硫与浸渣1的ZnFeO4反应的化学方程式为4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4。
(1)闪锌矿粉碎的目的是增大固体不氧气的接触面积,提高反应速率,故答案为:增大固体不氧气的接触面积,提高反应速率。
(2)“滤液 1”中选用足量的 H2O2,理由是将 Fe2+完全氧化成 Fe3+,避免引入杂质。假设“②调节 pH前,滤液1中 c(Fe3+)=1molL-1 ,则Fe3+完全沉淀时,![]() ,
,![]() ,
,![]() ,pH = 3,故答案为:将Fe2+完全氧化成Fe3+,避免引入杂质;3。
,pH = 3,故答案为:将Fe2+完全氧化成Fe3+,避免引入杂质;3。
(3)由于滤液2中加入锌粉,其主要是将铜离子置换出来,锌可能可能,因此“滤渣3”的成分为Zn和Cu或者Cu,故答案为:Zn和Cu或者Cu。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案,主要将固体A溶于稀硫酸中,再用酸性高锰酸钾来验证亚铁离子,故答案为:取少量固体A于试管中,加入稀硫酸完全溶解后,滴加酸性KMnO4紫红色褪色,则含有Fe2+。
(5)气体A为二氧化硫与浸渣1的ZnFeO4反应的化学方程式为4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4,故答案为:4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4
。


科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种无机精细化工产品,实验室用蚀刻废液![]() 主要含
主要含![]() 、HCl等
、HCl等![]() 制备CuCl的实验流程如下.
制备CuCl的实验流程如下.

![]() 滤渣1的主要成分为 ______ ;还原时生成
滤渣1的主要成分为 ______ ;还原时生成![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
![]() 加水时发生反应的离子方程式为 ______
加水时发生反应的离子方程式为 ______ ![]() 过滤时用的硅酸盐质仪器除烧杯外还有 ______
过滤时用的硅酸盐质仪器除烧杯外还有 ______ ![]() 滤液2的用途是 ______ .
滤液2的用途是 ______ .
![]() 用稀盐酸洗涤的目的是 ______ .
用稀盐酸洗涤的目的是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 mol H2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)![]() 2HI(g) 下列说法正确的是( )
2HI(g) 下列说法正确的是( )
A. 保持容器容积不变,向其中加入1molI2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molHe,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1 mol H2(g)和1molI2(g),化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molHe,化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃时,将amol H2(g)和bmol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)= ______,c(I2)= ______,而c(HI)=______,所以化学反应速率V正最大,而V逆最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)______,c(I2)______,而c(HI)______,从而化学反应速率v(正)______,而v(逆)______。
(3)当反应进行到v(正)与v(逆)相等时,此可逆反应就达到了平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如图:
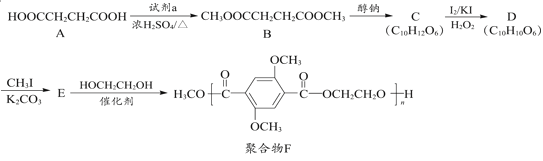
已知:
ⅰ.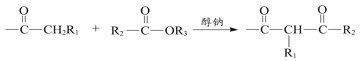 +R3OH
+R3OH
ⅱ. +R1I
+R1I +HI
+HI
ⅲ.R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
回答下列问题:
(1)A中官能团的结构简式为___。
(2)试剂a的名称___。1molD与足量的氢氧化钠溶液反应所需氢氧化钠的物质的量___。
(3)C中含有一个六元环,C的结构简式为___。
(4)C→D的反应类型为___。
(5)E→F的化学方程式是___。
(6)下列说法正确的是___(填序号)。
a.A能与NaHCO3溶液反应
b.醇钠可由醇与氢氧化钠反应制得
c.用FeCl3溶液不能鉴别D和E
d.HOCH2CH2OH俗称甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是![]()
A.反应![]() 室温下不能自发进行,则该反应的
室温下不能自发进行,则该反应的![]()
B.配制硫酸亚铁溶液时,需将![]() 先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
C.![]() 溶液加蒸馏水稀释,
溶液加蒸馏水稀释,![]() 的水解程度增大,溶液的pH减小
的水解程度增大,溶液的pH减小
D.在硫酸钡悬浊液中加入足量饱和![]() 溶液处理,向所得沉淀中加入盐酸有气体产生,说明
溶液处理,向所得沉淀中加入盐酸有气体产生,说明![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2 的分解反应为: COCl2(g)=Cl2(g)+CO(g) △H=+108 kJmol-1。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是

A.第 4min 时,改变的反应条件是升高温度
B.第 6min 时,V 正(COCl2)>V 逆(COCl2)
C.第 8min 时的平衡常数 K=2.34
D.第 10min 到 14min 未标出 COCl2 的浓度变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,已知X元素的最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径在其所处的族中最小。
B | ||
A | X | C |
D |
请回答下列问题:
(1)X的元素符号是___________。
(2)D元素的最高正化合价是_______________。
(3)写出C的气态氢化物的电子式__________________________。
(4)写出工业上合成B的气态氢化物的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用一直是研究课题。某地天然海水(主要含 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子),研究用海水吸收燃煤排放的含有
等离子),研究用海水吸收燃煤排放的含有![]() 烟气的工艺流程如图所示,下列说法中正确的是( )
烟气的工艺流程如图所示,下列说法中正确的是( )
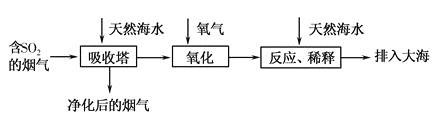
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为![]()
C.排入大海的溶液与天然海水相比,只有![]() 数量发生了变化
数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中![]() 含量最高
含量最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com