
| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
分析 当在恒温下将该容器体积扩大一倍,如平衡不移动,则A气体的浓度应为0.25mol.L-1,而A气体的浓度为0.3mol.L-1,说明平衡向逆反应方向移动,以此解答.
解答 解:当在恒温下将该容器体积扩大一倍,如平衡不移动,则A气体的浓度应为0.25mol.L-1,而A气体的浓度为0.3mol.L-1,说明平衡向逆反应方向移动.
A.平衡向逆反应方向移动,C的质量减小,而混合气体总质量不变,故C的质量分数降低,故A正确;
B.由上述分析可知,平衡向逆反应方向移动,故B错误;
C.平衡向逆反应方向移动,B的转化率降低,故C错误;
D.减小压强,向气体体积增大的方向移动,则x+y>z,故D错误,
故选A.
点评 本题考查化学平衡移动,关键是利用假设法判断平衡移动的方向,难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水由液态变为玻璃态,体积缩小 | |
| B. | 水由液态变为玻璃态,体积膨胀 | |
| C. | 玻璃态是水的一种特殊状态晶体 | |
| D. | 玻璃态水是水分子在空间有规则排列形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z的氢化物结构式为
;Z的氢化物结构式为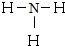 ;写出U元素在周期表中的位置第三周期第VIA族.
;写出U元素在周期表中的位置第三周期第VIA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com