
| A. | A、B可能属同一周期 | |
| B. | A位于B的前一周期 | |
| C. | A只能是金属元素 | |
| D. | A可能是第二周期的ⅡA族或ⅣA族元素 |
分析 短周期的A、B两种元素,A原子半径小于B的原子半径,A为正价,A的半径比B的半径小,则A应在第二周期,B在在第三周期;两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,则A应为第二周期IIA族或IVA族元素,以此来解答.
解答 解:A.若在同周期,A为正价,A在B的前面,则A的半径比B的半径大,与A原子半径小于B的原子半径矛盾,故A错误;
B.A原子半径小于B的原子半径,A为正价,A的半径比B的半径小,则A应在第二周期,B在在第三周期,故B正确;
C.两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,即A为C时属于非金属元素,故C错误;
D.两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,则A应为第二周期IIA族或IVA族元素,故D正确;
故选BD.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,明确原子半径和化合价来确定元素的位置是解答本题的关键,注意掌握原子结构与元素周期律的关系.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:实验题
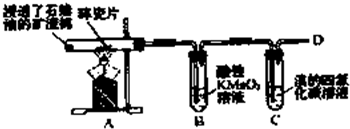 乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.
乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、NO3-、OH- | B. | Ag+、K+、SO42-、Cl- | ||
| C. | H+、Na+、OH-、Cl- | D. | Ca2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| C. | 加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+ | |
| D. | 滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或Na+[:H]-(写一例)
或Na+[:H]-(写一例)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com