
| A. | CH3COOCH3 | B. | CH3OH | C. | HCOOH | D. | HCHO |
分析 核磁共振氢谱中峰值数等于有机物中氢原子的种类数,核磁共振氢谱中只有一组峰,说明该分子中的H原子都是等效的,只有1种H原子,等效氢判断:①同一碳原子上的氢原子是等效的,②同一碳原子上所连接甲基上的氢原子是等效的,③处于同一对称位置的碳原子上的氢原子是等效的.
解答 解:核磁共振氢谱中只有一组峰,说明该分子中的H原子都是等效的,只有1种H原子.
A.CH3COOCH3中甲基连接的原子不同,所处化学环境不同,甲基H原子不同,有2种H原子,核磁共振氢谱中有2组峰,故A错误;
B.CH3OH中2个H原子连接不同的原子,所处化学环境不相同,有2种H原子,核磁共振氢谱中有2组峰,故B错误;
C.HCOOH中2个H原子连接不同的原子,所处化学环境不相同,有2种H原子,核磁共振氢谱中有2组峰,故C错误;
D.HCHO中2个H原子都连接C═O,所处化学环境相同,只有1种H原子,核磁共振氢谱中有1组峰,故D正确;
故选D.
点评 本题考查核磁共振氢谱,难度不大,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数.


科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 加入铁触媒做催化剂更有利于工业合成氨 | |
| D. | 锌粒粉碎后与稀硫酸反应产生氢气速度更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
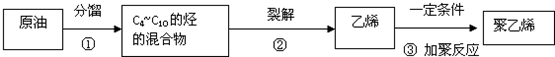
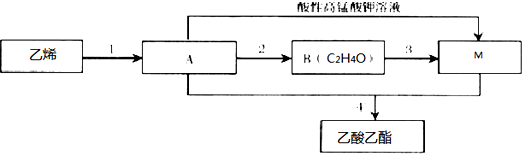
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 点燃可燃性气体前必须验纯 | |
| C. | 气体实验装置在实验前要进行气密性检查 | |
| D. | 滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 看如图完成下面的填空,写出电极反应式和总反应式.
看如图完成下面的填空,写出电极反应式和总反应式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
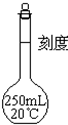 配制250mL 1mol/LNaOH溶液.回答下列问题:
配制250mL 1mol/LNaOH溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
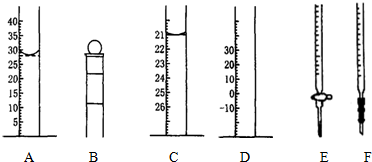
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com