
| A、电子所在的电子层 |
| B、电子的自旋方向 |
| C、电子云的形状 |
| D、电子云的伸展方向 |
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
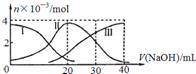 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是( )| A、滴加过程中当溶液呈中性时,V(NaOH)≥20mL |
| B、当V(NaOH)=30mL时,则有:2c(Na+)=3c(A2-)+3c(HA-) |
| C、H 2A在水中的电离方程式是:H 2A→H++HA-; HA-?H++A2- |
| D、当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CN-中碳元素的化合价为+2 |
| B、该反应的产物之一是无毒的N2 |
| C、当1 mol CN-参与反应时,转移3 mol e- |
| D、处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O=2NaOH | ||||
| B、2F2+2H2O=4HF+O2 | ||||
| C、C+H2O=CO+H2 | ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径呈周期性变化 |
| B、元素化合价呈周期性变化 |
| C、电子层数逐渐增加 |
| D、元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5molCl2与铁反应转移电子数为NA |
| B、在标准状况下,NA个任何分子所占的体积均约为22.4L |
| C、300mL 5mol/L KNO3溶液与300mL 5mol/L KCl溶液含有的离子数均约为3NA |
| D、16gO2和O3中所含的氧原子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用化学平衡常数判断化学反应进行的快慢 |
| B、利用溶解度数据判断氧化还原反应发生的可能性 |
| C、利用沸点数据推测将一些液体混合物分离的可能性 |
| D、利用物质的摩尔质量判断相同状态下不同物质密度的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | H-O | H-H | C-O | C=O |
| 键能/KJ mol-1 | 413 | 463 | 436 | 358 | 802 |
 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度/mol?L-1 | 2.00 | 0.50 | 0 |
| 平衡浓度/mol?L-1 | c1 | 1.00 | c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com