
| A. | 金属性比钾强 | B. | 最高价氧化物的化学式是SeO3 | ||
| C. | 高价含氧酸的酸性:H2SeO4>H2SO4 | D. | 氢化物稳定性:H2Se>H2O |
分析 Se与O元素同一主族,性质与O元素相似,与K同一周期,且原子序数大于K,所以其金属性小于钾,
A.同一周期元素,元素的金属性随着原子序数增大而减弱;
B.主族元素最高正价与其族序数相等,但O、F元素除外;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.非金属性越强氢化物越稳定.
解答 解:Se与O元素同一主族,性质与O元素相似,与K同一周期,且原子序数大于K,所以其金属性小于钾,
A.同一周期元素,元素的金属性随着原子序数增大而减弱,则金属性K>Se,故A错误;
B.主族元素最高正价与其族序数相等,但O、F元素除外,所以其最高正化合价为+6价,则最高价氧化物的化学式是SeO3,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>Se,则酸性:H2SeO4<H2SO4,故C错误;
D.同一主族元素,元素的非金属性随着原子序数增大而减弱,非金属性O>Se,所以氢化物稳定性:H2Se<H2O,故D错误;
故选B.
点评 本题考查同一主族元素性质递变规律,为高频考点,侧重考查分析判断及知识迁移能力,同一主族元素具有相似性及递变性,熟悉元素周期律内涵,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢元素的离子的电子层排布与氖原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
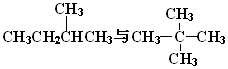 G.
G.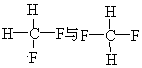
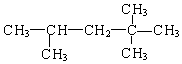 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式
;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式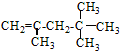 、
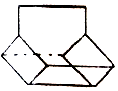
、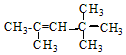 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/(mol•L-1) | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
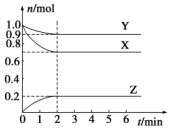 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能/KJ•mol-1 | 436 | 431 | 242 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞 | 产生气体,气体可燃,溶液变浅红色 |
| ②向新制得Na2S饱和溶液中滴加新制氯水 | 生成淡黄色沉淀 |
| ③钠与滴有酚酞试液的冷水反应 | 浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色 |
| ④镁带与2mol/L的盐酸反应 | 剧烈反应,产生的气体可燃 |
| ⑤铝条与2mol/L的盐酸反应 | 反应不十分剧烈;产生的气体可燃 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | 先生成白色絮状沉淀,最后沉淀全部溶解 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| ① | 不填 | 不填 |
| ② | S2-+Cl2=S↓+2Cl- | |
| ③ | 不填 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ④ | 不填 | 不填 |
| ⑤ | 不填 | 2Al+6H+=2Al3++3H2↑ |
| ⑥ | 先生成白色絮状沉淀,最后沉淀全部溶解 | Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA是强酸 | |
| B. | 混合液中,c(HA)+c(A-)=0.4mol•L-1 | |
| C. | 混合液中,c(Na+)+c(H+)=$\frac{Ka(HA)•c(HA)+Kw}{c({H}^{+})}$ | |
| D. | 向混合液中加入蒸馏水,c(A-)与c(HA)的比值将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com