

分析 (1)化学平衡常数是指一定温度下,当一个可逆反应达到化学平衡时,生成物浓度系数之幂的积与反应物浓度系数之幂的积比值,吸附小分子的肌红蛋白(MbX)的个数等于生成MbX的个数,由K=$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$可得c(Mb)=$\frac{c(MbX)}{K\frac{P}{po}}$,吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例等于$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{\frac{c(MbX)}{K\frac{P}{po}}+c(MbX)}$=$\frac{K\frac{P}{po}}{K\frac{P}{po}+1}$;
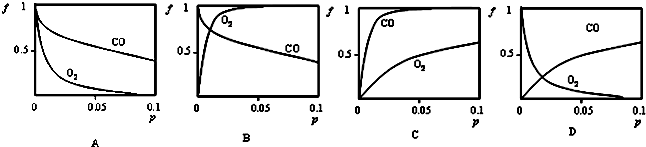
(2)增大压强,平衡正向移动,因此无论是CO还是O2,随着压强的增大,结合率(f)都是逐渐增大.在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),说明肌红蛋白与CO的结合能力比其与O2的结合能力强,所以相同压强条件下,肌红蛋白与CO的结合率(f)更大;
(3)已知:①Hb(aq)+H+(aq)?HbH+(aq);△H1,K1
②HbH+(aq)+O2(g)?HbHO2(aq)+H+;△H2,K2
由盖斯定律可知:①+②可得Hb(aq)+O2(g)?HbO2(aq)△H,
因此△H=△H1+△H2,K=K1•K2;
反应Hb(aq)+O2(g)?HbO2(aq),△S<0,由△G=△H3-T•△S<0自发可知,低温下反应③能自发进行,说明△H3<0;
(4)当pH>7.4时,与PH=7.4时相比,氢离子浓度减小,HbH+(aq)+O2(g)?HbHO2(aq)+H+的化学平衡正向移动,增大了血红蛋白氧结合率(f);
(5)保持其他条件不变,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大,同时压强增大,平衡正向移动,浓度减小,t3时达到平衡,平衡时浓度比原来大,t4时降低温度,平衡正向移动,浓度减小,t5时达到平衡,平衡时浓度比原来小.
解答 解:(1)Mb(aq)+X(g)?MbX(aq)的化学平衡常数K=$\frac{c(MbX)}{c(Mb)•c(X)}$=$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$;吸附小分子的肌红蛋白(MbX)的个数等于生成MbX的个数,由K=$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$可得c(Mb)=$\frac{c(MbX)}{K\frac{P}{po}}$,吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例等于$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{\frac{c(MbX)}{K\frac{P}{po}}+c(MbX)}$=$\frac{K\frac{P}{po}}{K\frac{P}{po}+1}$;
故答案为:$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$;$\frac{K\frac{P}{po}}{K\frac{P}{po}+1}$;
(2)对于Mb(aq)+X(g)?MbX(aq),增大压强,平衡正向移动,因此无论是CO还是O2,随着压强的增大,结合率(f)都是逐渐增大.在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),说明肌红蛋白与CO的结合能力比其与O2的结合能力强,所以相同压强条件下,肌红蛋白与CO的结合率(f)更大,因此C图象符合,
故选C;
(3)已知:①Hb(aq)+H+(aq)?HbH+(aq);△H1,K1
②HbH+(aq)+O2(g)?HbHO2(aq)+H+;△H2,K2
由盖斯定律可知:①+②可得Hb(aq)+O2(g)?HbO2(aq)△H,
因此△H=△H1+△H2,K=K1•K2;
反应Hb(aq)+O2(g)?HbO2(aq),△S<0,由△G=△H3-T•△S<0自发可知,低温下反应③能自发进行,说明△H3<0;
故答案为:△H1+△H2;K1•K2;<;<;
(4)当pH>7.4时,与PH=7.4时相比,氢离子浓度减小,HbH+(aq)+O2(g)?HbHO2(aq)+H+的化学平衡正向移动,增大了血红蛋白氧结合率(f),因此A曲线符合;
故答案为:A;
(5)保持其他条件不变,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大,同时压强增大,平衡正向移动,浓度减小,t3时达到平衡,平衡时浓度比原来大,t4时降低温度,平衡正向移动,浓度减小,t5时达到平衡,平衡时浓度比原来小,则t2~t6CO2的浓度随时间的变化如图: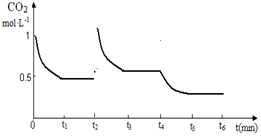 ,故答案为:
,故答案为: .
.
点评 本题考查了化学平衡常数的计算、化学平衡的移动、反应热的计算、化学反应进行的方向等问题,综合性很强,难度较大,题干素材涉及生物知识,很好的考查了学生化学反应原理的掌握水平.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: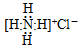 | |
| B. | 对硝基甲苯: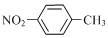 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: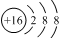 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
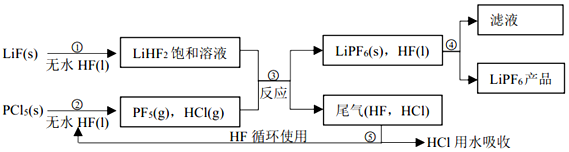
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
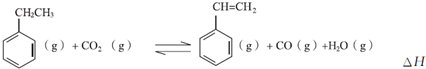
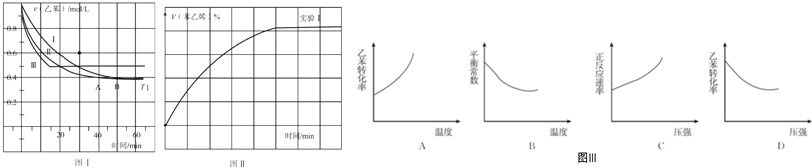

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
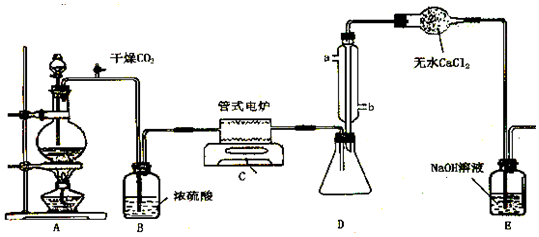
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3是某些胃药的一种成分 | |
| B. | 乳酸铁是某些补铁口服液的有效成分 | |
| C. | 臭氧可以作为新型自来水消毒剂 | |
| D. | SO2常用作红葡萄酒中杀菌消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com