

分析 (1)由短周期元素A-K的化合价与原子序数的关系图可知,J元素最低负价为-2,最高正价为+6,且处于短周期,故J应为S;
(2)元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
(3)电子层数越多,半径越大,同一周期,原子序数越大,半径越小;
(4)元素的非金属性越强,其气态氢化物越稳定,据此解答即可.
解答 解:(1)由短周期元素A-K的化合价与原子序数的关系图可知,J元素最低负价为-2,最高正价为+6,且处于短周期,故J应为S,S处于第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,由于非金属性:Cl>S>P,故高氯酸的酸性最强,化学式为HClO4,故答案为:HClO4;
(3)电子层数越多,半径越大,同一周期,原子序数越大,半径越小,B、C、F、I分别为:N、O、Mg、P,故半径大小顺序为:Mg>P>N>O,
故答案为:Mg>P>N>O;
(4)元素的非金属性越强,其气态氢化物越稳定,A-K元素中非金属性最强的是F,故HF最稳定,故答案为:HF.
点评 本题主要考查的是元素周期律以及元素周期表的综合应用,熟练准确掌握原子序数与元素化合价的关系是解决本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
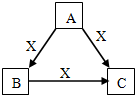 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 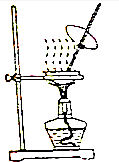 可用来蒸发FeCl3 溶液获得纯FeCl3 固体 | |
| B. |  可用向上排空气法收集CO2、NO 等气体 | |
| C. | 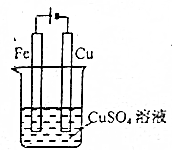 可以实现在铁棒上镀上一层铜 | |
| D. | 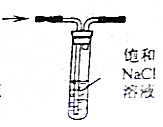 可以除去Cl2中混有的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系.
A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系. 、D
、D .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
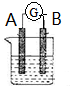 如图所示为原电池装置示意图.
如图所示为原电池装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
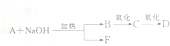
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com