
已知五种元素的原子序数的大小顺序为C>A>?B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试完成下列问题。(1)写出五种元素的名称。
A__________,B__________,C__________,D__________,E__________。
(2)用电子式表示离子化合物A2B的形成过程____________________。
(3)写出D元素形成的单质的结构式__________。
(4)写出下列物质的电子式。
E和B形成的化合物__________;A、B、E形成的化合物__________;D、E形成的化合物__________。
(5)A、B两元素组成的化合物A2B2属于__________(选“离子”“共价”)化合物,存在的化学键是__________,写出A2B2与水反应的化学方程式______________________________。
(1)钠 氧 硫 氮 氢 (2)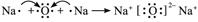
(3) (4)H∶
(4)H∶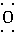 ∶H(或H∶
∶H(或H∶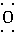 ∶
∶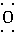 ∶H) Na+[∶
∶H) Na+[∶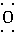 ∶H]- H∶
∶H]- H∶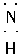 ∶H
∶H
(5)离子 离子键和共价键 2Na2O2+2H2O====4NaOH+O2↑
【解析】
试题分析:因为A、B离子的电子层数相同,在电子总数为30的A2B型化合物中,每个离子的电子为10个,可推出A是Na,B是O;又因为D和E形成4核10电子分子,只能是NH3,原子序数D>E,故D是N,E是H。C与A(Na)同周期,与B(O)同主族,所以C位于第3周期第ⅥA族,因此是S。
考点:考查元素周期表的结构、元素周期律的原因以及常见化学用语的书写
点评:该题是高考中的常见题型,试题难易适中,综合性强。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


科目:高中化学 来源: 题型:
(16分)A、B、C、D、E为原子序www.ks5u.com数依次增大的五种短周期元素,已知A的一种核素的质量数为另一种核素质量数的2倍,A和C、B和E分别位于同一主族,且B、E的质子数之和是A、C质子数之和的2倍,C、D、E这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。试回答:![]()
(1)写出下列元素的符号:A_______、E______。![]()
(2)C、D、E三种元素离子半径由大到小的顺序是 _________(填相应的离子符号)。![]()
(3)由A、B两元素形成的原子个数比为1∶1化合物的电子式是_______。![]()
(4)C、D元素的最高价氧化物的水化物之间反应的离子方程式是:_________。![]()
(5)用多孔石墨电极电解滴有酚酞的C元素和氯元素形成的化合物的饱和溶液,接通电源一段时间后,_______极(填电极名称)附近出现红色,另一极的电极反应式为_______,可用___________检验该电极所得产物。![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com