
【题目】下列化学式只表示一种纯净物的是( )
A.C3H8B.C4H10C.C2H4Br2D.C3H8O
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2 +2H2O ,
Cl2↑+MnCl2 +2H2O ,
(1)反应物HCl中氯元素的化合价____,HCl在反应中表现的性质包括_______和______。
(2)在该氧化还原反应中,MnO2 做_________剂,锰元素被________。
(3)写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的![]() 在
在![]() 中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.05molNaClO。氢气和氯气物质的量之比是( )
中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.05molNaClO。氢气和氯气物质的量之比是( )
A.2:3B.3:1C.1:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应
B. 用溴水可以区分苯乙烯和乙苯
C. 1 mol苯乙烯最多可与4 mol氢气加成,加成产物的一氯代物共有5种
D. 乙苯和苯乙烯分子中共平面的碳原子数最多都为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将酸HA与碱MOH等体积混合。
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显_______(填“酸性”、“中性”或“碱性”,下同)。
(2)若pH=3的强酸HA与pH=11的弱碱MOH混合,则所得溶液显__________。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显__________,解释这一现象的离子方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下0.1mol·L-1的盐酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者_____(填“>”“<”或“=”)。
II.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)__ V(乙) (填“>”“<”或“=”)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO3— B.CO32— C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________。
Ⅲ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
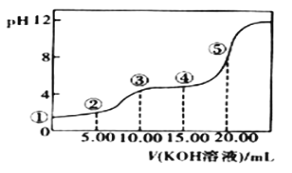
(1)点③所示溶液中所有离子的浓度由大到小的顺序为:_____________________。
(2)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与水反应生成的次氯酸具有杀菌作用,常用于自来水的消毒,用此种方法处理的自来水需要经过暴晒后才能用于养金鱼。下列有关说法正确的是
A. 次氯酸中氯元素呈-1价 B. 次氯酸属于电解质
C. 次氯酸的化学性质很稳定 D. Cl2与水的反应中无电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。

(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______(填标号)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是_____________________________。
②此样品中二氧化锗含量是_________。(保留四位有效数字)
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________加剧所致。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com