
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )
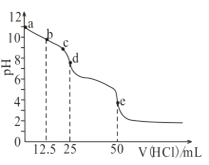
A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
【答案】C
【解析】A,b点加入12.5mL的盐酸,得到等物质的量浓度的NaHCO3、Na2CO3和NaCl的混合液,由于CO32-的水解能力大于HCO3-的水解能力,则c(HCO3-)![]() c(CO32-)
c(CO32-)![]() c(OH-),A项错误;B,d点加入25mL的盐酸,得到等物质的量浓度的NaHCO3和NaCl的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中的物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)]=2c(Cl-),两式整理得c(H+)+c(H2CO3)=c(OH-)+c(CO32-),B项错误;C,e点加入50mL盐酸,得到NaCl和H2CO3的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),NaCl属于强酸强碱盐,c(Na+)=c(Cl-),则c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项正确;D,c→d发生的主要离子反应为CO32-+H+=HCO3-,D项错误;答案选C。
c(OH-),A项错误;B,d点加入25mL的盐酸,得到等物质的量浓度的NaHCO3和NaCl的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中的物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)]=2c(Cl-),两式整理得c(H+)+c(H2CO3)=c(OH-)+c(CO32-),B项错误;C,e点加入50mL盐酸,得到NaCl和H2CO3的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),NaCl属于强酸强碱盐,c(Na+)=c(Cl-),则c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项正确;D,c→d发生的主要离子反应为CO32-+H+=HCO3-,D项错误;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
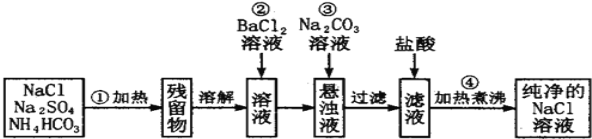
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,某pH=2的HCl溶液中,由水电离的c(H+)为( )
A. 1.0×10-12mol·L-1 B. 1.0×10-7mol·L-1 C. 1.0×10-10mol·L-1 D. 1.0×10-2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
C. 用Pt做电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
D. 用碳棒做电极电解CuSO4溶液一段时间后,加入Cu(OH)2固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组CH3COOH、CH3COONa的混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )

A. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L
B. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C. W点所表示的溶液中:c(H+)=c(CH3COOH)+c(OH-)
D. 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
A. 1 molKClO3参加反应有1mole- 转移 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. KClO3在反应中得到电子,作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____
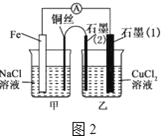
(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com