
 .
. ,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;
,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;分析 五种短周期元素A、B、C、D、E的原子序数依次增大,B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素;A、B、C三种元素原子核外电子层数之和是5,结合原子序数可知,A处于第一周期,则A为H元素,C处于第二周期,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数,则C原子最外层电子数为1+4=5,故C为N元素;A和C可以形成化合物NH3;B与D的原子序数之比为3:4,则D的原子序数为8,故D为O元素;E元素原子最外层电子数比次外层电子数少1,原子序数大于O元素,处于第三周期,则E最外层电子数为7,为Cl元素,据此进行解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大,B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素;A、B、C三种元素原子核外电子层数之和是5,结合原子序数可知,A处于第一周期,则A为H元素,C处于第二周期,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数,则C原子最外层电子数为1+4=5,故C为N元素;A和C可以形成化合物NH3;B与D的原子序数之比为3:4,则D的原子序数为8,故D为O元素;E元素原子最外层电子数比次外层电子数少1,原子序数大于O元素,处于第三周期,则E最外层电子数为7,为Cl元素,
(1)A、B分别为H、C元素,二者形成的10电子的分子为甲烷,甲烷分子中含有4个C-H键,其电子式为 ,
,
故答案为: ;
;
(2)A、B、C、D分别为H、C、N、O元素,四种元素组成的化合物既可以与盐酸反应又可以与NaOH溶液反应,且甲为无机正盐,则该化合物为碳酸铵,化学式为(NH4)2CO3,碳酸铵为离子化合物,其化学式中含有离子键和共价键,
故答案为:(NH4)2CO3;离子键和共价键;
(3)H、O按照1:1形成的化合物为H2O2,H2O2为共价化合物,其电子式为 ,双氧水在催化剂存在条件下能够发生分解生成氧气,反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2,
,双氧水在催化剂存在条件下能够发生分解生成氧气,反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2,
故答案为: ;2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;
;2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;
(4)①具有相同质子数的原子一定属于同种元素,该微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,故①错误;
②电子数相同的微粒不一定是同一种元素,如K+和Ca2+,具有相同的电子数,但不是同种元素,故②正确;
③两个原子如果核外电子排布相同,则核外电子数相等,而原子中核内质子数=核外电子数,元素的种类由核电荷数(即核内质子数)来决定,所以两个原子如果核外电子排布相同,一定是同一种元素,故③正确;
④分子中质子数=电子数,而离子中质子数≠电子数,若两粒子中质子数相同,电子数肯定不同,所以质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子,故④正确;
⑤分子或原子中质子数和电子数相等,所以所含质子数和电子数相等的微粒不一定是原子,可能为分子,故⑤错误;
⑥原子的质量数=质子数+中子数,而同一元素的质子数相同,中子数可能不同,所以同种元素的原子其质量数不一定相等,故⑥错误;
根据分析可知,正确的为②③④,
故答案为:B;
(5)A.H、D、T属于氢元素的不同种原子,互称为同位素,其余不属于同位素,故A错误;
B.H、D、T、D+、H-属于氢元素的不同种微粒,HD和H2均是氢元素形成的单质,故B错误;
C.H、D、T、HD、H2、D+、H-这七种微粒,有原子与离子和分子,电子数不同,故C错误;
D.HD和H2均是氢元素形成的单质,故D正确;
故答案为:D.
点评 本题考查位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题知识点较多,充分考查了学生的分析能力及综合应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
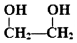 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式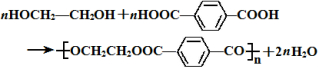 ;
;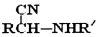 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$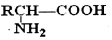
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②.
中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②. ,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:
,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式: .
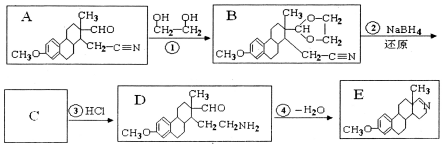
. 下列流程是A的一种合成方法,写出方框中各物质的结构简式:
下列流程是A的一种合成方法,写出方框中各物质的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com