
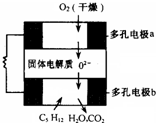
 设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一.最近有人设计了一种固体燃料电池,固体氧化铝--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一.最近有人设计了一种固体燃料电池,固体氧化铝--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A、b极为电池的正极 |
| B、b极对应的电极反应式为:C5H12+16O2--32e-=5CO2+6H2O |
| C、该电池的总反应方程式为:C5H12+8O2+10OH-=5CO32-+11H2O |
| D、汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效能减弱 |


科目:高中化学 来源: 题型:
| A、反应速率:前者慢,后者快 |
| B、消耗硝酸的物质的量:前者多,后者少 |
| C、反应生成气体的颜色:前者浅,后者深 |
| D、反应中转移的电子总数:两者相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②>①>④>③ |
| B、③>④>①>② |
| C、③>④>②>① |
| D、④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z的氢化物的热稳定性强于W的氢化物 |
| B、X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
| C、Z的氧化物与水反应可制得相应的含氧酸 |
| D、X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O
| ||||
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | ||||
| C、将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:3AlO2-+6H+=2 Al(OH)3↓+Al3+ | ||||
| D、NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
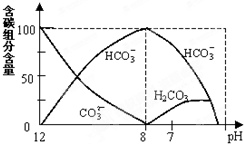 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.c(H
| ||
c(
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com