
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1
下列措施中能够增大上述合成甲醇反应的反应速率的是(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2 , 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图1所示. 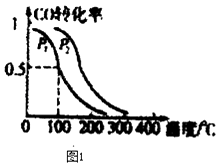
①p1p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=;
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2号 CH3OH各0.5amol,则平衡(填“向右”、“向左”或“不”移动)
④在其它条件不变的情况下,再增加a mol CO和2a molH2 , 达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”).
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示.在T1﹣T2及T4﹣T5两个温度区间,容器内甲醇的体积分数的变化趋势如图2所示,其原因是 . 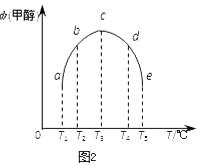
【答案】
(1)﹣90.1;a、c
(2)小于;![]() ;向左;增大
;向左;增大
(3)T1﹣T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3﹣T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少
【解析】解:(1)①CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣764.5kJmol﹣1②CO(g)+
O2(g)═CO2(g)+2H2O(l)△H=﹣764.5kJmol﹣1②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJmol﹣1
O2(g)═CO2(g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJmol﹣1 ,
O2(g)═H2O(l)△H=﹣285.8kJmol﹣1 ,
依据盖斯定律②+③×2﹣①得:CO(g)+2H2(g)═CH3OH(g)△H,则△H=△H2+2△H3﹣△H1=﹣90.1KJ/mol;
反应为气体体积减小的放热反应,能够增大上述合成甲醇反应的反应速率的是,
a.使用高效催化剂,降低反应的活化能,可以加快反应速率,故a正确;
b.降低反应温度减慢反应速率,故b错误;
c.增大体系压强反应速率增大,故c正确;
d.不断将CH3OH从反应混合物中分离出来,生成物难度减小,反应速率减小,故d错误;
故选ac,
所以答案是:﹣90.1; a、c;(2)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)CH3OH(g)可知压强越大,
越有利于平衡向正反应进行,故压强P1<P2 ,
所以答案是:小于;
②由于平衡常数与压强没有关系,所以根据图像可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+ | 2H2(g) | = | CH3OH(g) | |
起始浓度(mol/L) |
|
| 0 | |
转化浓度(mol/L) |
|
|
| |
平衡浓度(mol/L) |
|
|
|
所以平衡常数K= 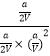 =
= ![]() ,
,
所以答案是: ![]() ;③在其它条件不变的情况下,向容器中通入CO、H2、CH3OH各0.5amol,等效减小氢气的浓度,平衡向逆反应移动,
;③在其它条件不变的情况下,向容器中通入CO、H2、CH3OH各0.5amol,等效减小氢气的浓度,平衡向逆反应移动,
所以答案是:向左;④在其它条件不变的情况下,再增加a mol CO和2a molH2 , 相当于压强增大,平衡正向进行达到新平衡时,CO的转化率增大,
所以答案是:增大;(3)反应进行到t时刻时,a、b没有达到平衡状态,c、d、e达到平衡状态,故T1﹣T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3﹣T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少,
所以答案是:T1﹣T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3﹣T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少;
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】胡妥油(D)用作香料的原料,它可由A合成得到( ) 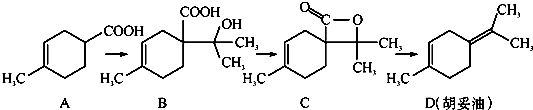
A.从B到C的反应是消去反应
B.D分子中所有碳原子一定共面
C.等物质的量的B分别与足量的Na、NaHCO3反应,产生的气体的物质的量前者大于后者
D.若A是由2﹣甲基﹣1,3﹣丁二烯和丙烯酸(CH2=CHCOOH)加热得到的,则该反应的类型属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 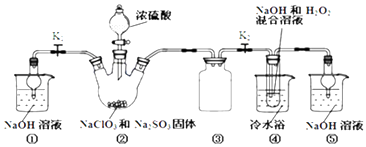
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会祥云火炬将中国传统文化、奥运精神及现代科技融为一体,火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: 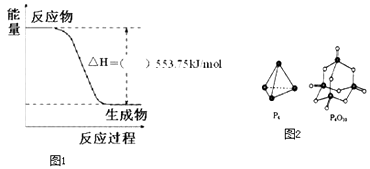
(1)如图1是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”).
写出表示丙烷燃烧热的热化学方程式:
(2)甲醇是一种清洁燃料,甲醇的燃烧热为726.51kJ/mol,若1mol甲醇和丙烷的混合物完全燃烧生成CO2和液态水共放出热量2498.4KJ,则混合物中甲醇和丙烷的物质的量之比为 .
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式 .
(4)已知断裂下列化学键需要吸收的能量分别为P﹣P:akJmol﹣1、P﹣O:bkJmol﹣1、P=O:ckJmol﹣1、O=O:dkJmol﹣1 . 根据如图2所示的分子结构和有关数据估算反应:P4(s)+5O2(g)=P4O10(s)的△H=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Ba2+ B. H+、Mg2+、Al3+
C. H+、Cu2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
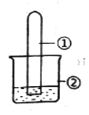
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.浓硫酸能与铜反应释放出氢气
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离于方程式书写正确的是
A. 向沸水中滴入FeCl3饱和溶液:Fe3+ +3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 向NaOH 溶液中通入过量二氧化硫:OH-+SO2=HSO3-
C. 将一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
D. 向Fe(NO3)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含分子的物质的量最多的是( )
A.4℃时2.7mL水B.含6.02×1023个氧原子的一氧化碳
C.6.02×1022个氯化氢分子D.4.9g磷酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com