
科目:高中化学 来源: 题型:
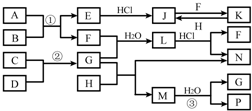
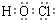
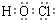
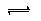 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大查看答案和解析>>
科目:高中化学 来源: 题型:

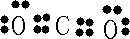
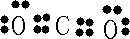
 H++Cl-+HClO
H++Cl-+HClO H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
A.石灰石跟盐酸反应:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.氯气跟水反应:Cl2+H2O![]() H++Cl-+ClO-
H++Cl-+ClO-
C.钠跟水反应:Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
D.硫酸铜溶液和氢氧化钡溶液反应:Ba2++![]()
![]() BaSO4↓
BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是()
A.Cl2通入到FeCl2溶液中
2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
B.Cl2和H2O反应
Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
C.Cl2通入到KI溶液中
I-+Cl2![]() I2+Cl-
I2+Cl-
D.Cl2被NaOH溶液吸收
Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省扬州市普通高中学业水平测试化学(必修)模拟试卷(一) 题型:单选题
下列离子方程式书写正确的是
| A.铜与稀硝酸的反应:Cu+4H++2NO3-= Cu2++2NO2↑+2H2O |
B.氯气与水反应:Cl2+H2O H++Cl-+HClO H++Cl-+HClO |
| C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com