
【题目】研究发现某些金属离子如 Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较 MnO2与 Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验。
请回答相关问题:
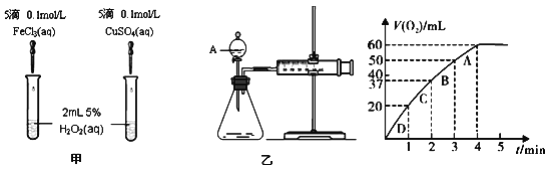
(1)定性分析:图甲可通过观察__________(填写相关实验现象), 定性比较得出结论。有同学提出将FeCl3 改为 Fe2(SO4)3 或者将 CuSO4 改为 CuCl2 更为合理,其理由是______________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。检查乙装置气密性的方法是_____________,实验中需要测量的数据是___________。
(3)加入0.10mol MnO2 粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①实验时放出气体的总体积是_______mL, 反应放出气体所需时间约为_________min。
②A、B、C、D各点反应速率快慢的顺序为 D>C>B>A.解释反应速率变化的原因:______________。
③计算 H2O2 的初始物质的量浓度为__________mol/L。(保留两位有效数字)
【答案】(1)产生气泡的快慢(2分)消除阴离子不同对实验的干扰(2分)
(2)关闭分液漏斗活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位(2分)产生40mL气体所需的时间(2分)
(3)①60(1分)4(1分)②随着反应的进行,浓度减小,反应速率减慢(2分)③0.11(2分)
【解析】
试题分析:(1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)检验气密性可通过关闭分液漏斗活塞,将注射器活塞向外拉出一段,如活塞回到原位说明气密性良好;比较化学反应速率大小,可用生成相同体积气体所需时间,或相同时间内生成气体的体积进行判断;
(3)①当反应进行到4min时,反应结束,生成气体的体积最大为60mL;
②由于随着反应的进行,浓度减小,因此导致反应速率减慢;
③根据方程式计算
2H2O=2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=2mol×0.06L/22.4L=0.00536mol,
所以c(H2O2)=0,00536mol/0.05L=0.11 molL-1。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.增大反应物浓度,平衡正向移动,反应物的转化率一定增大
B.正、逆反应速率改变时,平衡一定发生移动
C.对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡
D.增大体系压强,化学反应速率加快,化学平衡一定正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015北京理综化学】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
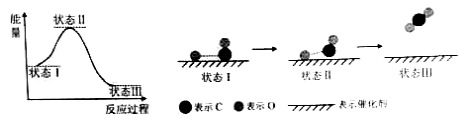
下列说法中正确的是 ( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A. 碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
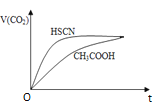
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
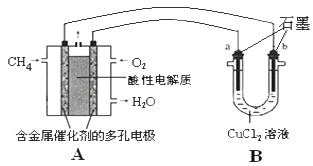
①甲烷燃料电池的负极反应式是____________
② 当A中消耗0.15mol氧气时.B 中____极增重_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于甲烷的说法中错误的是( )
A.甲烷分子具有正四面体结构
B.甲烷化学性质比较稳定,不被任何氧化剂氧化
C.甲烷分子中具有极性键
D.甲烷分子中四个C﹣H键是完全等价的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、M均为中学化学常见物质,它们的转化关系如下图所示(部分生成物和反应条件略去)。A与水的反应在常温下进行。下列推断不正确的是( )
A. 若A为淡黄色固体,则D可能为CO
B. 若M为可溶性铝盐,则D可能为白色沉淀,且M(D)=M(A)
C. 若D为小苏打,C转化为D的反应是CO2+H2O+CO32-=2HCO3-,则A可能为氯气
D. 若C为CO2,则A一定为化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com