
【题目】己知下列物质的K:CaCO35×10-9;BaSO41×10-10:BaCO35×10-8:Mg(OH)25.6×10-12;Ca(OH)21.4×10-5,氯碱工业中,电解所用的饱和食盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+),精制流程如下(注:溶液A为NaOH溶液)

①盐泥a除泥沙外,还含有的物质是___。
②过程Ⅰ中将NH4+转化为N2的离子方程式是___。
⑨过程Ⅱ中除去的离子有___。
【答案】Mg(OH)2 2NH4++3Cl2+8OH-=N2+6Cl-+8H2O SO42-、Ca2+
【解析】
粗盐水与淡盐水混合,发生两个反应,一个是Cl2与NH4+的氧化还原反应(生成N2、Cl-等),另一个是Mg2+与OH-的反应(生成氢氧化镁沉淀),可由溶度积常数进行计算确认;盐水a中加入BaCO3,可通过溶度积常数的比较,确定生成BaSO4、CaCO3沉淀;盐水b中加入Na2SO3,与Cl2发生氧化还原反应(生成SO42-、Cl-等);盐水c中调pH,可去除大部分OH-,得到精制盐水。
①pH=11,c(OH-)=10-3mol/L,c(Mg2+)=![]() =5.6×10-6mol/L,c(Ca2+)=
=5.6×10-6mol/L,c(Ca2+)=![]() =14mol/L,由此可确定,溶液中的Mg2+完全沉淀,而Ca2+大量存在;因此,盐泥a除泥沙外,还含有的物质是Mg(OH)2。答案为:Mg(OH)2;
=14mol/L,由此可确定,溶液中的Mg2+完全沉淀,而Ca2+大量存在;因此,盐泥a除泥沙外,还含有的物质是Mg(OH)2。答案为:Mg(OH)2;
②由分析可知,过程Ⅰ中将NH4+转化为N2,需使用Cl2作氧化剂,离子方程式是2NH4++3Cl2+8OH-=N2+6Cl-+8H2O。答案为:2NH4++3Cl2+8OH-=N2+6Cl-+8H2O;
⑨过程Ⅱ中,盐水a中加入BaCO3,比较三者的Ksp:CaCO3为5×10-9、BaSO4为1×10-10、BaCO3为5×10-8,可以看出,CaCO3、BaSO4的Ksp都比BaCO3的Ksp小,所以溶液中的Ca2+、SO42-都与BaCO3发生反应,转化为沉淀除去,故过程Ⅱ除去的离子有SO42-、Ca2+。答案为:SO42-、Ca2+。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:

已知:①![]() +
+![]() Δ
Δ![]() ;②R-C≡N
;②R-C≡N![]() R-COOH。
R-COOH。
回答下列问题:
(1)A的名称是________
(2)C的结构简式为_______
(3)![]() 发生缩聚反应的有机产物的结构简式为________。
发生缩聚反应的有机产物的结构简式为________。
(4)E→F的化学方程式为_______.
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是________(写结构简式)。
(6)写出用苯乙烯![]() 为原料制备化合物
为原料制备化合物![]() 的合成线路,其他无机试剂任选______。
的合成线路,其他无机试剂任选______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
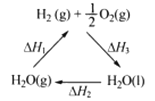
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
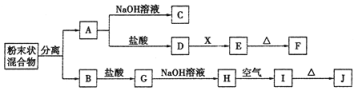
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置制取氯气,下列说法不正确的是( )

A.该装置图中至少存在两处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升,根据实验现象判断下列说法错误的是( )

A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
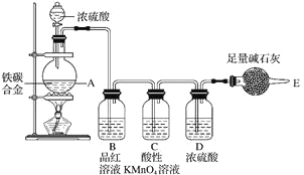
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;
②__。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式__。
(3)B中的现象是__,C的作用是__。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为__(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:__。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g) ![]() CO(g)+2H2(g) △H1=+90.64 kJ/mol
CO(g)+2H2(g) △H1=+90.64 kJ/mol
水蒸气变换反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H2=-41.20 kJ/mol
CO2(g)+H2(g) △H2=-41.20 kJ/mol
则CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H3=____________kJ/mol
CO2(g)+3H2(g) △H3=____________kJ/mol
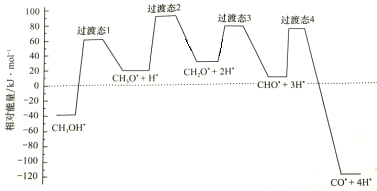
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为________________________________________________。
(3)在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是_____________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,a、c曲线对应物质的化学式分别为_______________、______________。
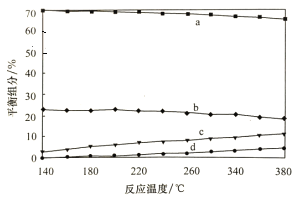
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____________MPa/h,其平衡常数分压Kp=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com