
分析 ①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;根据溶液呈中性pH=7c(H+)=c(OH-)结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)进行解答;
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)]进行解答.
解答 解:①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),溶液中的溶质为乙酸钠溶液,水的电离是微弱的,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)],得到c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-),则c(OH-)-c(H+)-c(CH3COOH)=c(CH3COO-)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO-)+c(CH3COOH)═$\frac{0.1000mol/L×20mL}{60mL}$=0.033mol/L,
故答案为:0.033.
点评 本题考查了酸碱中和反应中的离子浓度的有关计算以及盐溶液中的三个守恒的运用,难度不大,注意基础的掌握.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )
常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )| A. | 酸B比酸A的电离度大 | B. | A为弱酸,B为强酸 | ||
| C. | 酸B的物质的量浓度比A的小 | D. | A酸比B酸易电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为75% | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 采集某雨水样品,放置一段时间,pH由4.8变为4.2,是因为水中溶解了较多的CO2 | |
| D. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的FeI2溶液与溴水等体积混合 2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | Ba(OH)2溶液中加入过量的NaHSO4溶液 Ba2++OH-+H++SO42-═H2O+BaSO4↓ | |
| C. | 氢氧化亚铁溶液于稀硝酸中 Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 向漂白粉溶液中通入少量的二氧化碳 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.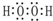 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com