
分析 18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,结合题目所给条件,即可确定所需答案.
解答 解:18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,
(1)含有18e-的A+、B-、C2-分别为K+、Cl-、S2-,所以A元素为K,
故答案为:K;
(2)含18个电子的微粒中氧化能力最强的为F2,
故答案为:F2;
(3)由两种元素组成的三原子分子为H2S,
故答案为:H2S;
(4)含有4个原子的18e-微粒中,分子式为H2O2或PH3,常体现氧化性,其分子式是H2O2,
故答案为:H2O2.
点评 本题考查18电子微粒的结构和性质,题目难度不大,本题注意常见10电子和18电子微粒,把握相关物质的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
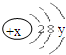 试回答:
试回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
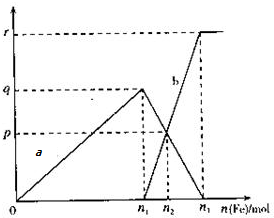 在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:
在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 四种元素中只有一种是金属,下列说法错误的是( )
四种元素中只有一种是金属,下列说法错误的是( )| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 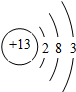 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q的一种同位素可用于测定文物的年代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水不可以长期排向水库 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
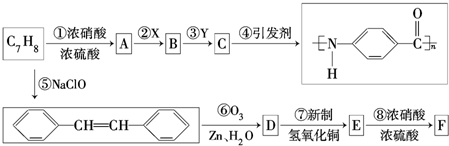
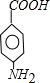 .
.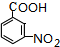 .
. $\stackrel{引发剂}{→}$
$\stackrel{引发剂}{→}$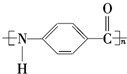 +n H2O、
+n H2O、 +2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+
+2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+ 、
、 +HNO3$→_{△}^{浓H_{2}SO_{4}}$
+HNO3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com