
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①④ |
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,气体的物质的量与体积成反比 | |
| B. | 同温同体积时,气体的物质的量与压强成反比 | |
| C. | 同温同物质的量时,气体的压强与体积成正比 | |
| D. | 同压同体积时,气体的物质的量与温度成反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
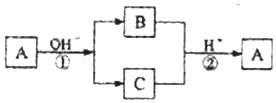
| A. | X元素可能为Al | B. | X元素可能为金属,也可能为非金属 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃,1.01×105Pa下 11.2LN2含有的分子数为3.01×1023 | |
| B. | 4℃时9mL水和标准状况下11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,lmol NO与lmol N2和O2的混合气体的体积不相等 | |
| D. | 0℃、1.01×10sPa时,11.2L氧气所含的原子数目为3.01×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,20mL NH3跟60mL O2所含的分子个数比为1:3 | |
| B. | 22.4L O2中一定含有6.02×1023个氧分子 | |
| C. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| D. | 18克H2O在标准状况下的体积为0.018L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
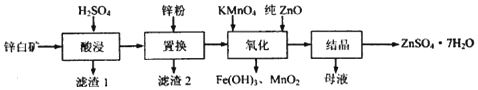
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com