
下列各项比较中前者高于(或大于或强于)后者的是( )
|
| A. | CCl4和SiCl4的熔点 |
|
| B. | 邻羟基苯甲醛( |
|
| C. | SO2和CO2在水中的溶解度 |
|
| D. | H2SO3和H2SO4的酸性 |
考点:
晶体的类型与物质熔点、硬度、导电性等的关系;不同晶体的结构微粒及微粒间作用力的区别.
专题:
化学键与晶体结构.
分析:
A.根据分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大;
B.分子内形成氢键,使熔沸点降低,分子间氢键,使熔沸点升高;
C.根据价层电子对互斥理论确定分子空间构型,根据相似相溶原理分析物质的溶解性,SO2在水中溶解度比CO2大;
D.同等条件下亚硫酸比硫酸酸性弱;
解答:
解:A.分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大,所以SiCl4的沸点比CCl4的高,故A错误;
B.邻羟基苯甲醛的两个基团靠的很近,能形成分子内氢键,使熔沸点降低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点升高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故B错误;
C.二氧化硫分子中价层电子对个数=2+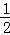 (6﹣2×2)=3且含有一个孤电子对,所以为V形结构,SO2是V形的极性分子,CO2是直线型的非极性分子,根据相似相溶原理,SO2在水中的溶解度比CO2的大,故C正确;
(6﹣2×2)=3且含有一个孤电子对,所以为V形结构,SO2是V形的极性分子,CO2是直线型的非极性分子,根据相似相溶原理,SO2在水中的溶解度比CO2的大,故C正确;
D.H2SO3是二元弱酸,H2SO4是二元强酸,同等条件下亚硫酸比硫酸酸性弱,故D错误;
故选C.
点评:
本题考查较为综合,涉及沸点比较、溶解度比较以及酸性比较等知识,题目难度中等,注意把握比较的方法和角度,注意相似相溶原理、注意氢键对熔沸点的影响,分子内形成氢键,使熔沸点降低;分子间氢键,使熔沸点升高.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
在体积为VL的密闭容器中,充入a molN2和b molH2,经3分钟生成c molNH3.试回答下面问题:
(1)以N2为研究对象,计算其速率v(N2)的值
(2)求H2的转化率
(3)求3分钟时NH3的体积分数
(4)计算反应前后的压强之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒的个数比不是1:1的是( )
|
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 |
|
| C. | Na2O2固体中阴、阳离子 | D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ•mol﹣1).
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 | … |
下列关于元素R的判断中一定正确的是( )
|
| A. | R的最高正价为+3价 |
|
| B. | R元素位于元素周期表中第ⅡA族 |
|
| C. | R元素的原子最外层共有4个电子 |
|
| D. | R元素基态原子的电子排布式为1s22s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
|
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 |
|
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
|
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 |
|
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应mA(g)+nB(g)⇌pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是( )
|
| A. | m+n>p+q,正反应吸热 | B. | m+n<p+q,正反应放热 |
|
| C. | m+n>p+q,正反应放热 | D. | m+n<p+q,正反应吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com