
| A. | 1:2:3 | B. | 1:3:3 | C. | 1:6:9 | D. | 1:3:6 |
分析 硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应,分别发生3BaCl2+Al2(SO4)3 ═3BaSO4↓+2AlCl3、ZnSO4+BaCl2═BaSO4↓+ZnCl2、Na2SO4+BaCl2=BaSO4↓+2NaCl,结合化学方程式计算.
解答 解:硫酸钡的化学式为BaSO4,假设等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应,设生成的硫酸钡沉淀的质量均为233g,n=$\frac{233g}{233g/mol}$=1mol,等体积的硫酸铝、硫酸锌、硫酸钠溶液,物质的量比等于浓度比,
由3BaCl2+Al2(SO4)3 ═3BaSO4↓+2AlCl3、ZnSO4+BaCl2═BaSO4↓+ZnCl2、Na2SO4+BaCl2=BaSO4↓+2NaCl,Al2(SO4)3只需要$\frac{1}{3}$mol,ZnSO4、Na2SO4均需要1mol,则硫酸铝、硫酸锌、硫酸钠溶液的物质的量浓度之比为1:3:3,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室中用生石灰与浓氨水混合的方法不能制得氨气 | |
| B. | 中和滴定实验中,所用滴定管和锥形瓶均不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
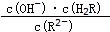 将减小(填“增大”或“减小”或“不变”或“无法判断”)
将减小(填“增大”或“减小”或“不变”或“无法判断”)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1g | B. | 0.01g | C. | 0.001g | D. | 0.0001g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴化钙用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.工业上利用海水和贝壳为原料制备CaBr2•2H2O的主要流程如下:
溴化钙用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.工业上利用海水和贝壳为原料制备CaBr2•2H2O的主要流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [A-]>[B+]>[H+]>[OH-] | B. | [B+]>[A-]>[H+]>[OH-] | C. | [B+]>[A-]>[OH-]=[H+] | D. | [A-]>[B+]>[OH-]>[H+] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com