
某课外研究小组用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为
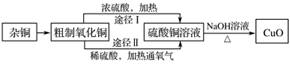
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________(填字母)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________。
科目:高中化学 来源: 题型:
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。
(1)化学实验必须以实验安全为前提。下列操作不存在安全隐患的是__________(填写编号)。
①用手直接拿取金属钠
②用无水醋酸钠和碱石灰混合加热制取甲烷,把产生的气体直接点燃,观察燃烧现象
③把消石灰与NH4Cl固体混合加热产生的气体用导管直接通入水中制取浓氨水
④为防止药品污染,将实验剩余的钠块放入垃圾桶中
⑤氢气还原氧化铜的实验,先通一段时间氢气,验纯后再点燃酒精灯加热
⑥白磷在水下切割
(2)熟悉常见实验仪器的作用及操作要领是做好实验的基础,在实验台桌面上摆有如图所示仪器,按要求回答下列问题:
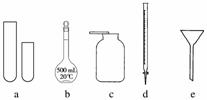
①指导教师要求同学们写出仪器的名称,甲同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则此空不需要填写)。
| 仪器编号 | a | b | c | d | e |
| 名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
| 改正的名称 |
②关于e的用途,乙同学说:组成防倒吸装置。你还能说出其他两种用途吗?
A.________________________________________________________________________;
B.________________________________________________________________________。
③d仪器在使用前必须检查是否漏水,检查漏水的操作是________________________________________________________________________。
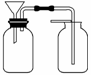
(3)实验装置的改进及创新能培养同学们的创造能力,丙同学想用如图所示装置用大理石和稀盐酸反应制取CO2。老师指出,这需要太多的稀盐酸,会造成浪费。该同学选用了上面的一种仪器,加在装置中,解决了这个问题。请你把该仪器画在图中合适的位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为(提示:Si+2OH-+H2O===SiO +2H2↑)( )
+2H2↑)( )
样品
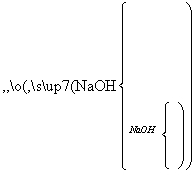
A.Al、Mg、Si、Zn B.Al、Fe、Zn、Na
C.Al、Na、Cu、Fe D.Al、Cu、Mg、Si、Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH溶液中加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80 ℃,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是______________________。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白:
(1)图中标号处需加入的相应物质分别是
①____________、②____________、③____________、
④____________、⑤____________。
(2)写出①处发生反应的离子方程式________________________________________
________________________________________________________________________;
写出③处发生反应的化学方程式__________________________________________。
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________________________________________________________________;
氧化铜________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持及加热仪器已略)。
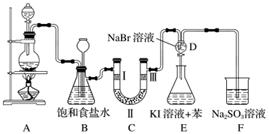
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关反应的化学方程式为__________________________。
装置B中饱和食盐水的作用是____________________。
同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:______________________________________________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入的物质为________(填字母)
| 选项 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入少量氯气时,可以看到无色溶液逐淅
变为________色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是______________________________________________。
(4)装置F中用足量的Na2SO3溶液吸收多余氯气,试写出相应反应的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com