
| A. | ①③④⑤ | B. | ①②④⑥ | C. | ①②③⑥ | D. | ②③⑤⑥ |
分析 ①由同一种元素组成的物质可能是混合物,也可能是单质;
②阴离子可能含金属元素,阳离子不一定含金属元素;
③碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物;
④酸性氧化物不一定是非金属氧化物,可能是金属氧化物;
⑤按酸分子中电离出的氢离子数目不同确定酸的元数;
⑥无氧酸不一定是非金属的氢化物.
解答 解:①由同一种元素组成的物质可能是混合物,也可能是单质,如氧气和臭氧是混合物但二者组成元素相同,故错误;
②阴离子可能含金属元素,如AlO2-,阳离子不一定含金属元素,如H+,故错误;
③碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Al2O3,故正确;
④酸性氧化物不一定是非金属氧化物,可能是金属氧化物,如Mn2O7,故错误;
⑤根据酸能电离出的氢离子的个数可以将酸分为一元酸、二元酸和多元酸,但酸的元数不一定等于酸中的H原子数,如CH3COOH,含4个氢原子但是一元酸,故正确;
⑥无氧酸不一定是非金属的氢化物,如HCN,故错误;
故选B.
点评 本题考查物质结构及基本概念,为高频考点,明确概念内涵及外延、物质结构是解本题关键,易错选项是⑤,一般学生往往根据酸中H原子个数判断酸的元数,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 反应③中1mol还原剂反应,则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在体积可变的密闭容器中发生可逆反应 A(g)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | |
| B. | 对于反应 C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率可能减小 | |
| C. | 向 0.1 mol•L-1的氨水中加入氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}0)}$增大 | |
| D. | 常温下,向 Mg(OH)2悬浊液中加入 MgCl2浓溶液后,溶液中$\frac{c(M{g}^{2+})•c(O{H}^{-})}{c({H}^{+})}$不变(一定温度下,Mg(OH)2悬浊液中 c(Mg2+)﹒c2(OH-)为定值) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
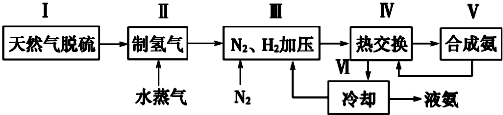
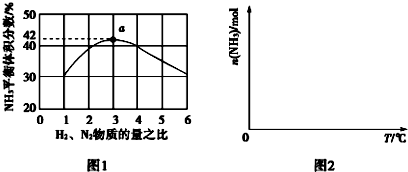
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成的难易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 | H2、Br2混合,加热时发生化合 | H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
| A. | 同周期元素的金属性随原子序数递增而增强 | |
| B. | 同周期元素的非金属性随原子序数递增而增强 | |
| C. | 第VIIA族元素的非金属性随电子层数的增加而减弱 | |
| D. | 第VIIA族元素的金属性随电子层数增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+O2↑ | |
| B. | 氯化铁溶液和氢氧化钠溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| B. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| C. | 向0.1mol/L CH3COOH溶液中加入少量的冰醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$的值变小 | |
| D. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com