
A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)二 ⅣA, N, Cl (每空1分)
(2)三角锥形, 1:2 (每空1分)
(3)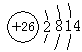
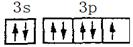 (3s、3p未注明也得分)
(3s、3p未注明也得分)
1s22s22p63s23p63d104s1 或 [Ar] 3d104s1 (每空1分)
(4)2Fe3++Cu=2Fe2++Cu2+, Be(OH)2+2NaOH=Na2BeO2+2H2O(每空2分)
解析试题分析:A的原子核外有6种不同运动状态的电子,即核外共有6个电子,A为碳元素。C的基态原子中s电子总数与p电子总数相等,则核外电子排布为1s22s22p4,C是氧元素。由于A、B、C原子序数依次递增,故B是氮元素。D的原子半径在同周期元素中最大,故D应为第三周期元素,是钠元素。E的基态原子最外层电子排布式为3s23p1,是铝元素。F的基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反,说明p轨道上有5个电子,是氯元素。G的基态原子核外有7个能级且能量最高的能级上有6个电子,则其电子排布式为1s22s22p63s23p64s23d6,是铁元素。H是我国使用最早的合金中的最主要元素,是铜元素。
考点:原子核子电子排布及物质结构


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
| | | |||||
| | | | N | | F | |
| Mg | Al | | | S | Cl | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
| | | J | | |
| | | | | R |
| | I1 | I2 | I3 | I4 | …… |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期中原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题。
(1)元素D在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________________。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
②若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________________________________________________________。
③FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁、戊五种短周期元素原子序数依次递增。甲最外层电子数是次外层的两倍,丙的次外层电子数比最外层少4个,丁形成的简单阳离子是同周期元素简单离子中半径最小的,戊是同周期主族元素中原子半径最小的。试用化学式回答下列问题:
(1)乙和戊形成的化合物中各原子最外层均满足8e-结构,其化学式为 ;
(2)写出乙的最高价氧化物的水化物的浓溶液与甲单质反应的化学方程式 ;
(3)戊的最高价氧化物与丁的最高价氧化物的水化物反应的离子反应方程式为 ;
(4)常温下戊单质被NaOH溶液吸收的化学方程式为 ;
(5)氢与丙形成原子个数比为1:1的液体,该物质中存在的作用力有( )
①极性键 ②非极性键 ③离子键 ④氢键 ⑤范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,根据要求回答下列问题。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | | | | E | H | F | I | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com