
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
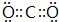 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式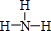 .
. .
.分析 短周期主族元素中,T元素原子M层上有6个电子,则T为S元素;W是短周期内原子半径最大的元素,则W为Na;N的原子序数比T(硫)小,且与T在同一主族,则N为O元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,据此解答.
解答 解:短周期主族元素中,T元素原子M层上有6个电子,则T为S元素;W是短周期内原子半径最大的元素,则W为Na;N的原子序数比T(硫)小,且与T在同一主族,则N为O元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素.
(1)元素Y为N元素,在周期表中的位置:第二周期第ⅤA族,
故答案为:第二周期第ⅤA族;
(2)CO2的电子式是: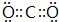 ,Y的简单氢化物为NH3,结构式为
,Y的简单氢化物为NH3,结构式为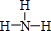 ,
,
故答案为: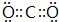 ;
;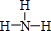 ;
;
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,
故答案为:HClO4;
(4)用电子式表示NaCl的形成过程: ,
,
故答案为: ;
;
(5)同周期自左而右元素非金属性增强,故非金属性较强的是Cl,
A.单质的状态属于物理性质,不能比较非金属性强弱,故A错误;
B.非金属性与氢化物稳定性一致,氯的氢化物比硫的氢化物稳定,说明Cl元素非金属性更强,故B正确;
C.非金属单质与氢氧化钠溶液反应不能判断非金属性强弱,如氧气不与氢氧化钠溶液反应,而硫可以,故C错误.
故答案为:Cl;B;
(6)Na单质和H2O反应的化学方程式:2Na+2H2O=2NaOH+H2↑,所得溶液的溶质是NaOH,属于离子化合物,
故答案为:2Na+2H2O=2NaOH+H2↑;离子.
点评 本题考查结构性质位置关系应用,注意掌握金属性、非金属性强弱比较实验事实,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释时溶液温度升高,说明浓硫酸稀释只有水合过程 | |
| B. | 蔗糖是非电解质,放入水中溶液温度没有明显变化,说明蔗糖溶于水既没有扩散过程也没有水合过程 | |
| C. | 家用石碱(Na2CO3•10H2O)久置后,由块状变成粉末状,这一变化是风化的结果 | |
| D. | 从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下CH3COONa溶液的pH值大于7 | |
| B. | 同温同浓度的盐酸与CH3COOH溶液比较,醋酸溶液导电能力弱 | |
| C. | CH3COOH不与NaCl反应 | |
| D. | 室温下0.1 mol/L CH3COOH溶液的pH=2.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的 3 倍 |
| X | 常温下单质为双原子分子,分子中含有 3 对共用电子对 |
| Y | M 层比 K 层少 1 个电子 |
| Z | 第 3 周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 | |
| B. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 | |
| C. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO${\;}_{3}^{-}$)+c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com