
| 加热前质量 | 加热后质量 | |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 5.4g | 7.9g | 6.8g |
分析 (1)首先根据实验步骤中的各步操作,确定所需的实验仪器,硫酸铜晶体里结晶水含量的测定用到天平、坩埚、玻璃棒、坩埚钳、干燥器、泥三角、三脚架等仪器;
(2)①根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水的含量及x的值,并判断结合的偏差;
(3)在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水,都会造成测量结果偏高、偏低;
(4)根据测定硫酸铜晶体中结晶水的正确操作方法进行判断.
解答 解:(1)测定CuSO4•nH2O的结晶水含量,方法是:称量样品→在坩埚中加热→冷却→称量无水盐,所以称量需天平,研钵常用于研磨固体物质或进行粉末状固体的混和,将硫酸铜晶体碾碎时需要用到的仪器名称为研钵、药匙,坩埚是实验室常用于灼烧固体物质的仪器,加热硫酸铜晶体需要将其盛放在坩埚中,所以不需要用的仪器为C,E,I,同时还需要仪器为研钵、药匙,
故答案为:C,E,I;玻璃棒;坩埚钳、干燥器、泥三角、三脚架中的任意两个;
(2)由表格中的数据,硫酸铜晶体的质量为 W2-W1=7.9g-5.4g=2.5g,水的质量:W3-W2=7.9g-6.8g=1.1g,H2O%=$\frac{1.1g}{2.5g}$×100%=44%,
则CuSO4.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O,
160+18x 18x
2.5g 1.1g
W2-W1 W3-W1
$\frac{160+18x}{{W}_{2}-{W}_{1}}$=$\frac{18x}{{W}_{3}-{W}_{1}}$,解得X=$\frac{80({W}_{3}-{W}_{1})}{9({W}_{2}-{W}_{3})}$;$\frac{160+18x}{2.5}$=$\frac{18x}{1.1}$,解得x≈7.0>5,所以该测定结果偏高,
故答案为:44%;7.0;偏高;
(3)(A) 加热过程中晶体有少量溅失,导致无水硫酸铜的质量测定结果偏大,故A偏高;
(B) 加热前称量时容器未完全干燥,导致水的质量测定结果偏大,故B偏高;
(C) 最后两次加热后的质量相差较大(大于0.1克),会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故C偏小;
(D) 加热后容器未放入干燥器内冷却,无水硫酸铜在高温下重新吸收水分,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故D偏小,
故选AB.
(4)在硫酸铜结晶水含量的测定实验中,实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,一般情况下,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,
故答案为:恒重.
点评 本题考查了实验室测定硫酸铜晶体结晶水含量实验,对失水得到产物的分析判断以及对实验结果产生的误差的原因进行分析是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 正常雨水PH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,可用泡沫灭火器灭火 | |
| C. | 在放电条件下,氮气和氧气化合生成二氧化氮 | |
| D. | 冷的浓硫酸与铁、铝反应时会使金属表面生成致密的氧化物而钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
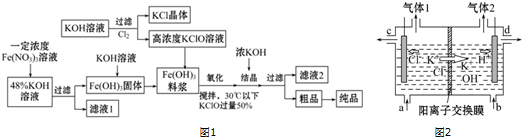
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.20 | B. | 0.16 | C. | 0.12 | D. | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维和光导纤维都是有机高分子材料 | |
| B. | SiO2是人类将太阳能转变为电能的常用材料 | |
| C. | 水晶、玛瑙、水泥和瓷器都是硅酸盐制品 | |
| D. | 氮化硅陶瓷是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打Na2CO3,苛性钠NaOH | B. | 明矾KAl(SO4)2•12H2O,消石灰Ca(OH)2 | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 纯碱NaOH,食盐NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化汽油不能萃取溴水中的溴 | |
| B. | 石油的分馏以及煤的气化和液化是物理变化 | |
| C. | 煤中含有大量的苯等芳香烃,煤是芳香烃的主要来源 | |
| D. | 煤属于有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
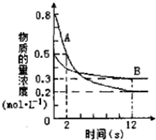 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )| A. | 前12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | 12s后,A的消耗速率等于B的生成速率 | |
| C. | 化学计量数之比b:c=1:2 | |
| D. | 12s内,A和B反应放出的热量为0.2Q kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com