


| 19.6 |
| 80% |
| ||
| 4min |
| 0.2 |
| 3 |
| 0.2 |
| 3 |
| 0.2 |
| 3 |
| 0.4 |
| 3 |
| 0.2 |
| 3 |
| 0.2 |
| 3 |
| 1 |
| 24 |
| 1 |
| 24 |
| 0.12 |
| 0.13x |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
A、 NaCl溶液 |
B、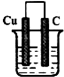 HCl溶液 |
C、 CuSO4溶液 |
D、 蔗糖溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L苯中含C-H数目为0.6 NA |
| B、常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA |
| C、常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| D、在反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、Al 3+、Fe3+、Cu2+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | a1 | a2 | a3 | a4 | a5 |
| A、a3>a1>a5>a4>a2 |
| B、a4>a2>a5>a3>a1 |
| C、a2>a4>a5>a1>a3 |
| D、a1>a3>a5>a2>a4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-═CH3COO-+H2O | ||
| C、苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2OC6H5OH+CO32- | ||
D、甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,我国部分地区多次陷入严重雾霾之中,其中一个重要的原因是我国的能源消费结构以燃煤为主,改变煤的利用方式可减少环境污染.以下是对煤进行处理的方法:
近年来,我国部分地区多次陷入严重雾霾之中,其中一个重要的原因是我国的能源消费结构以燃煤为主,改变煤的利用方式可减少环境污染.以下是对煤进行处理的方法:| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)═CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)═CH3OCH3(g)+H2O(g) | -23.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去FeCl2溶液中混有的FeCl3:加足量铁粉,过滤 |
| B、除去Al2O3中混有的SiO2:加NaOH溶液,过滤 |
| C、除去CO2中混有的HCl:用饱和碳酸钠溶液洗气 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com