
| A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2—3滴酚酞指示剂。 |
| B.用待测的NaOH溶液润洗碱式滴定管。 |
| C.把滴定管用蒸镏水洗净。 |
| D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻 |
科目:高中化学 来源:不详 题型:实验题
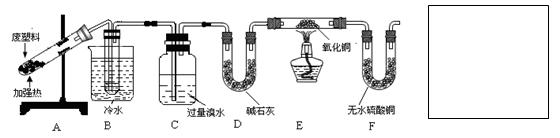
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.淀粉碘化钾溶液 | B.NaOH溶液 |
| C.FeCl2与KSCN混合溶液 | D.Na2SO3溶液 |
 对硬质玻璃管里的氧化铜粉末加热前,需进行的操作为 。
对硬质玻璃管里的氧化铜粉末加热前,需进行的操作为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步聚 | 实验操作 | 预期现象和结论 |
| 第一步 | | |
| 第二步 | | |
| 第三步 | | |
| 第四步 | | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
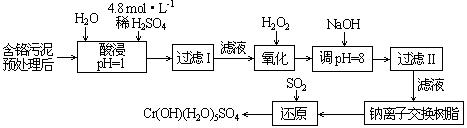
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 求出原稀溶液中I-浓度,滴定时的反应为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI。试回答:
求出原稀溶液中I-浓度,滴定时的反应为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI。试回答: ____________(填“是”或“不是”);若为AgX沉淀,则它的化学式为__________(若不为AgX沉淀,则此空不填)。
____________(填“是”或“不是”);若为AgX沉淀,则它的化学式为__________(若不为AgX沉淀,则此空不填)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验操作 |
| A | 实验室制备硝基苯 | 将苯和浓硝酸混合后加热 |
| B | 除去硫酸钠溶液中少量氯化钠杂质 | 向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤 |
| C | 检验溴乙烷发生消去反应的产物 | 向盛有少量溴乙烷的试管中,先加入氢氧化钠溶液,加热,再滴人用硝酸酸化 的硝酸银溶液 的硝酸银溶液 |
| D | 浓硝酸的氧化性强于稀硝酸 | 向盛有少量的浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com