
| A. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 放电时正极附近溶液的碱性减弱 |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱,阴极上电极反应式为Zn(OH)2+2e-=Zn+2OH-,生成氢氧根离子,所以阴极附近碱性增强.
解答 解:A、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故B正确;
C、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D、放电时,高铁酸钾在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,所以正极附近溶液的碱性增强,故D错误.
故选CD.
点评 本题主要考查了原电池和电解池原理的应用,侧重于考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力,题目难度中等.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列图示装置的实验中,操作正确的是
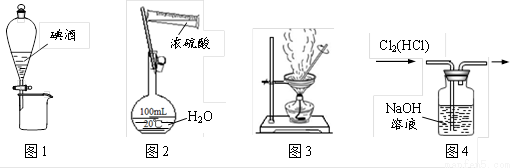
A. 图1分离碘酒中的碘和酒精 B. 图2稀释浓硫酸
C. 图3食盐水制得食盐晶体 D. 图4除去Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 | |
| B. | 碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 | |
| C. | 钢铁生锈、沙里淘金、蒸馏法制取纯净水都涉及了化学变化 | |
| D. | 工业酒精既可以用作燃料制“乙醇汽油”,又可以勾兑成白酒饮用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
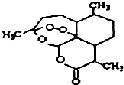 被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青篙素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中第15纵行(从左往右数)元素的最高正价为+5 | |
| B. | 元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 | |
| C. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| D. | 同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
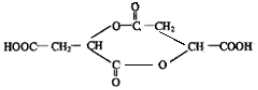 .
.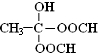 .(已知:
.(已知: )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由电子转移守恒和氯元素守恒可推出2b+a=6c | |
| B. | 若氯酸分解所得混合气体,在相同状态下密度是氢气的25.75信,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O | |
| C. | 由非金属性Cl>S,可推知酸性HClO4>H2SO4 | |
| D. | 若化学计量数a=3,b=2,则该反应转移电子数为10e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com