
【题目】将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气为0.25 mol
B.n(Na+):n(Cl-) 可能为7:3
C.若反应中转移的电子为n mol,则0.15n0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
【答案】C
【解析】
A.由于反应后体系中没有NaOH,故氢氧化钠反应完全,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气的物质的量n(Cl2)=0.15mol,A错误;
B.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5< n(Na+):n(Cl-)<2:1,7:3>2:1,B错误;
C.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,转移电子数最少,为0.3mol×![]() ×1=0.15mol,氧化产物只有NaClO3时,转移电子数最多,为0.3mol×
×1=0.15mol,氧化产物只有NaClO3时,转移电子数最多,为0.3mol×![]() ×1=0.25mol,C正确;
×1=0.25mol,C正确;
D.假设n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,D错误;
故合理选项是C。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:

(1)铜为___极,导线中电子流向为___(用a、b表示)。
(2)若装置中铜电极的质量增加3.2g,则导线中转移的电子数目为___;(用若NA表示阿伏加德罗常数,“NA”表示)
(3)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是___。
A.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
B.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
C.盐桥中的K+、Cl-几乎都不移动
(4)若将反应2Fe3+ +Cu=2Fe2+ +Cu2+设计成原电池,其正极反应是___。
(5)设计一个电化学装置,实现这个反应:Cu+H2SO4=CuSO4+H2↑,请在下面方框内画出这个电化学装置图。___

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一定能大量共存的离子组是 ( )
A.澄清透明溶液中:K+、Cu2+、Na+、Cl-
B.0.5 mol/L NaAlO2 溶液中:K+、Na+、SO42-、Fe3+
C. ![]() =0.1 mol/L的溶液中:Na+、K+、HCO3-、NO3-
=0.1 mol/L的溶液中:Na+、K+、HCO3-、NO3-
D.使甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,c(CH3COOH)+c(CH3COO-)=0.1molL-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
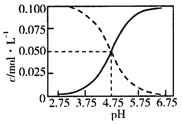
A.25℃时,CH3COOH的电离常数K的值5×10-2.75
B.随pH增大,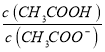 增大
增大
C.pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.5mol/L的NaOH溶液490mL,用质量分数为98%,密度为1.84 g/cm3的浓硫酸配制0.6mol/L的硫酸溶液500mL。请回答下列问题:
(1)计算需要NaOH固体质量_________ g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器_________(填序号),还缺少的仪器是_________。
(3)定容的具体操作方法是:________
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用__________ mL量筒最好。
(5)配制过程中,下列操作会引起结果偏高的是__________(填序号)
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
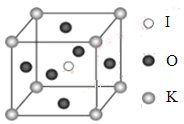
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脑白金的主要成分的结构简式如图:
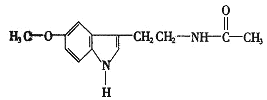
下列对脑白金主要成分的推论错误的是( )
A.其分子式为C13H16N2O2
B.能水解生成乙酸
C.能与溴水发生加成反应
D.其营养成分及官能团与葡萄糖相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛用途。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为_____________。
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:
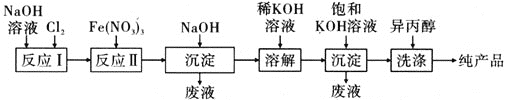
①反应Ⅰ的化学方程式为_________________________________________________。
②反应Ⅱ的离子方程式为_________________________________________________。
③加入饱和KOH溶液的目的是_________________________________________________。
④高铁酸钾是一种理想的水处理剂,其处理水的原理为____________________________。
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要________mL、4 mol·L-1 HNO3。

(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为________。电解后,阴极室得到的A溶液中溶质的主要成分为________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com