
KI在食品、医药领域有广泛用途。某科研小组利用碘废弃液(主要含I2、I-)制备KI,流程如下:
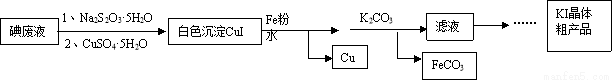
已知:I2+2S2O32-==S4O62-+2I-
(1)加入胆矾的作用 。
(2)为制得KI晶体粗产品,滤液后续操作步骤是 。
(3)用沉淀滴定法测定样品中KI含量的实验步骤如下:
a.称取3.000 g样品,溶解,配制成250 mL溶液
b.量取25.00 mL待测液于锥形瓶中
c.用0.1000 mol•L-1AgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液16.50 mL
①配制250mL样品溶液时,所需的仪器除烧杯、玻璃棒之外,还缺少的玻璃仪器是 。AgNO3标准溶液在使用之前通常要重新标定,原因是 ;本实验滴定过程中操作滴定管的图示正确的是______(填编号)。
③该样品中KI的质量百分数为 。
④下列因素会导致KI含量的测定结果偏高的是 。
A.配制样品溶液定容时仰视
B.锥形瓶未干燥
C.滴定管未用AgNO3标准溶液润洗
D.滴定终点时滴定管尖嘴中产生气泡
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高一上段考化学试卷(解析版) 题型:推断题
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体,而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、E的化学式:A_______________;B_______________;E_______________
(2)写出F和H反应的化学方程式 。
(3)按要求写方程式:
① 加热固体D发生反应的化学反应方程式 。
② C与足量盐酸反应的离子方程式 。
③ A溶液与金属铝反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东深圳高级中学高二上期中考试化学试卷(解析版) 题型:选择题
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断不正确的是
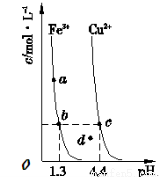
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2 ]
B.加适量NH4 Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+ )与c(OH-)乘积相等
D.Fe(OH)3 、Cu(OH)2 分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
下列反应的离子方程式不正确的是
A.氯化钡和稀硫酸反应:Ba2++SO42- = BaSO4↓
B.铁与稀盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.锌与硫酸铜溶液反应:Zn+Cu2+ = Zn2++Cu
D.氢氧化钠和盐酸反应:OH-+ H+ = H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是( )
)
A.K B.Ca C.Na D.Fe
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的数值,则下列说法正确的是
A.常温常压下,1mol氦气含有的核外电子数为4NA
B.0.25mol Na2O2中含有的阴离子数为0.5NA
C.50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA
D.25℃时,7g C2H4和C3H6的混合气体中,含有NA个C—H键
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:填空题
(15分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如图1所示:
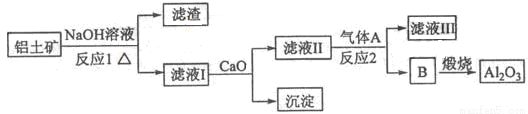
图1
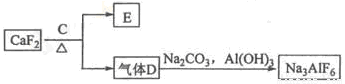
图2
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图2所示:
回答下列问题:
(1)写出反应1的化学方程式 ; 。
(2)滤液Ⅰ中加入CaO生成的沉淀是______,反应2的离子方程式为______;
(3)E可作为建筑材料,化合物C是______,写出由D制备冰晶石的化学方程式______;
(4)电解制铝的化学方程式是______,以石墨为电极,阳极产生的混合气体的成分是______。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上学期期中考试化学试卷(解析版) 题型:填空题
乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式 。
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g) 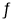 C2H5OH(g) H=-45.5KJ/mol
C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)
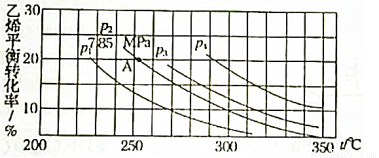
①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是 。
(3)若某温度下,反应C2H4(g)+H2O(g) 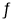 C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
物质的量分数 | 0.25 | 0.25 | 0.5 |
则v(正) v(逆)(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:选择题
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
①b不可能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性
A.③④ B.①③ C.②④ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com