
| A、电解精炼金属时,含杂质的粗金属做阳极,与电源正极相连 |
| B、电解池中金属导线中电子由电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 |
| C、在电解池中,电解质溶液中的阴离子向阴极移动,阳离子向阳极移动 |
| D、在电解精炼金属过程中,电解质溶液的成分不发生任何变化 |


科目:高中化学 来源: 题型:
| A、甲烷、乙烯 |
| B、乙烯、乙醇 |
| C、乙炔、苯 |
| D、丙烯、2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钙和镁 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④①⑤③ | B、⑥①⑤③ |
| C、⑧①⑦② | D、⑧②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
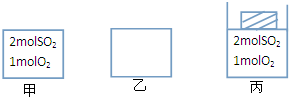 如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器.
如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com