
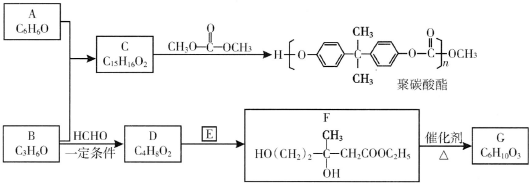
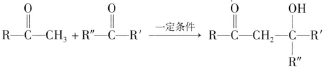 ��R��R�䡢R��Ϊ��ԭ�ӻ�������
��R��R�䡢R��Ϊ��ԭ�ӻ������� ��E�ķ���ʽ��C4H8O2��F����G�ķ�Ӧ������ȡ����Ӧ��
��E�ķ���ʽ��C4H8O2��F����G�ķ�Ӧ������ȡ����Ӧ�� ��G��ͬ���칹���ж��֣����к�G������ȫ��ͬ��״�ṹ��ͬ���칹����23�֣�������G�������������칹����
��G��ͬ���칹���ж��֣����к�G������ȫ��ͬ��״�ṹ��ͬ���칹����23�֣�������G�������������칹���� ���� A�ķ���ʽΪC6H6O���ҷ����ں��б�������AΪ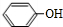 ����C��
����C��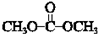 ��Ӧ���ɾ�̼�����Ľṹ�������Ϣii����֪CΪ
��Ӧ���ɾ�̼�����Ľṹ�������Ϣii����֪CΪ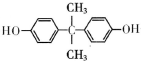 ��A��B��Ӧ����C��B������ֻ��һ����ԭ�ӣ����B�ķ���ʽ��C�Ľṹ��֪BΪ
��A��B��Ӧ����C��B������ֻ��һ����ԭ�ӣ����B�ķ���ʽ��C�Ľṹ��֪BΪ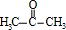 ��B��HCHO������Ϣi�ļӳɷ�Ӧ����DΪ
��B��HCHO������Ϣi�ļӳɷ�Ӧ����DΪ

��� �⣺A�ķ���ʽΪC6H6O���ҷ����ں��б�������AΪ ����C��
����C��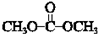 ��Ӧ���ɾ�̼�����Ľṹ�������Ϣii����֪CΪ
��Ӧ���ɾ�̼�����Ľṹ�������Ϣii����֪CΪ ��A��B��Ӧ����C��B������ֻ��һ����ԭ�ӣ����B�ķ���ʽ��C�Ľṹ��֪BΪ
��A��B��Ӧ����C��B������ֻ��һ����ԭ�ӣ����B�ķ���ʽ��C�Ľṹ��֪BΪ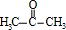 ��B��HCHO������Ϣi�ļӳɷ�Ӧ����DΪ
��B��HCHO������Ϣi�ļӳɷ�Ӧ����DΪ

��1��������������֪��AΪ���ӣ��ʴ�Ϊ�����ӣ�
��2����A��B��C�Ľṹ��֪��1molB��2molA����1molC����A��B���ʵ���������Ϊ2��1��
�ʴ�Ϊ��2��1��
��3��B��һ��ͬ���칹���ܷ���������Ӧ����ͬ���칹��ΪCH3CH2CHO������������Ӧ�ķ���ʽΪ��CH3CH2CHO+2Ag��NH3��2OH$\stackrel{��}{��}$CH3CH2COONH4+2Ag��+3NH3+H2O��
�ʴ�Ϊ��CH3CH2CHO+2Ag��NH3��2OH$\stackrel{��}{��}$CH3CH2COONH4+2Ag��+3NH3+H2O��
��4��������������֪��D�Ľṹ��ʽ��
�ʴ�Ϊ��
��5��������������֪��G�Ľṹ��ʽ��
�ʴ�Ϊ��
���� ���⿼���л�����ƶϣ���Ҫѧ���Ը���ķ�Ӧ�������ã��ܽϺõĿ���ѧ�����Ķ���������ѧ������ע������ת����ϵ���л���ķ���ʽ�����ƶϣ���ѧ�����������нϸߵ�Ҫ���ѶȽϴ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a g | B�� | 0.5a g | C�� | 4.4a g | D�� | 1.8a g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe3O4��ϡ���ᷴӦ��Fe3O4+8H+�T2Fe3++Fe2++4H2O | |
| B�� | �������������Һ��Ӧ��H++CH3COO-�TCH3COOH | |
| C�� | ��FeI2��Һ��ͨ����������2Fe2++Cl2�T2Fe3++2Cl- | |
| D�� | ��NH4Al��SO4��3��Һ�м�����������������Һ��NH4++OH-�TNH3•H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L0.1mol•L-1�Ĵ�����Һ�к���0.1NA��H+ | |
| B�� | 1L1mol•L-1��NaClO��Һ�к���ClO-����ĿΪNA | |
| C�� | 25��ʱ��1LpH=13��Ba��OH��2��Һ�к���OH-����ĿΪ0.2NA | |
| D�� | 1mol���ʹ躬��2NA��Si-Si�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ʵ���Ũ����ȵĢ٣�NH4��2CO3�ڣ�NH4��2SO4�ۣ�NH4��2Fe��SO4��2������Һ��c��NH4+���Ĵ�С˳��Ϊ���٣��ڣ��� | |
| B�� | ��0.1mol•L-1Na2CO3��Һ�У�c��OH-��-c��H+��=c��HCO3-��+2c��H2CO3�� | |
| C�� | ��0.2mol•L-1NaHCO3��Һ�м�������0.1mol•L-1NaOH��Һ��c��CO32-����c��HCO3-����c��OH-����c��H+�� | |
| D�� | 0.2mol•L-1HCl��0.1mol•L-1NaAlO2��Һ�������ϣ�c��Cl-����c��Na+����c��Al3+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | ����/��kJ•mol-1�� | ��ѧ�� | ����/��kJ•mol-1�� |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A�� | ������ȼ����Ϊ��H=-483kJ/mol | |
| B�� | H2��g��+I2��g��$\frac{200��}{\;}$2HI��g����H=-5kJ/mol | |
| C�� | N2��g��+3H2��g��?2NH3��g����H=-92kJ/mol | |
| D�� | ����ͬ�����£�������������ȫȼ�պ����������ȼ�յ��ʱ���ʱ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �����еķ�Ӧȫ�����Ƿ�������ԭ��Ӧ | |
| B�� | M������ | |
| C�� | �������MgO�ȵ������MgCl2�ƽ���þ����Լ���� | |
| D�� | ����bֻ�ǹ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com