
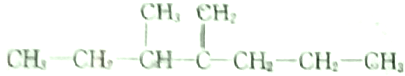 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯 ,可命名为1-甲基-3-乙基苯.
,可命名为1-甲基-3-乙基苯. 分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:(1)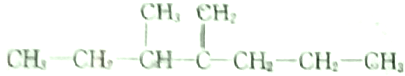 的最长碳链含有5个碳原子,为戊烯,在3号碳原子上有一个甲基,在2号碳原子上有一个丙基,命名为:3-甲基-2-丙基-1-戊烯,故答案为:3-甲基-2-丙基-1-戊烯;
的最长碳链含有5个碳原子,为戊烯,在3号碳原子上有一个甲基,在2号碳原子上有一个丙基,命名为:3-甲基-2-丙基-1-戊烯,故答案为:3-甲基-2-丙基-1-戊烯;
(2)有苯环的,命名时可以依次编号命名, 命名为:1-甲基-3-乙基苯,故答案为:1-甲基-3-乙基苯.
命名为:1-甲基-3-乙基苯,故答案为:1-甲基-3-乙基苯.
点评 本题考查了有机物的命名,题目难度中等,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 用食醋鉴别食盐和纯碱 | |
| B. | 用丁达尔效应现象鉴别蛋白质溶液和蔗糖溶液 | |
| C. | 用Ca(OH)2溶液鉴别SO2、CO2气体 | |
| D. | 用硝酸银溶液鉴别溴蒸气和二氧化氮气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A为NaOH溶液,乙为白色沉淀,则X可能为短周期金属元素 | |
| B. | 若A为硝酸,X为金属元素,则甲与乙反应可生成丙 | |
| C. | 若A为氧气,丙在通常状况下为红棕色气体,则甲可能为非金属单质 | |
| D. | 若乙为NaHCO3,则甲或丙可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)合成氨的反应原理为:
(2)合成氨的反应原理为:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol H2、2molN2 | 4mol H2、4molN2 | 2mol NH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| 平衡时N2的体积分数 | w1 | W2 | W3 |
| 混合气体的密度(g•L-1) | ρ1 | ρ2 | ρ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 | B. | Ca(OH)2 | C. | 饱和Na2CO3溶液 | D. | Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(ClO)2溶液中通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO3↓+Cl-+2HClO | |
| B. | 1 mol/L的NaAlO2溶液和2.5 mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
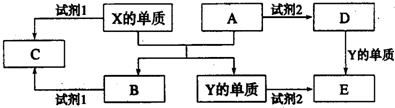
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素是具有相同核电荷数的同一类原子的总称 | |
| B. | 核素代表一类原子 | |
| C. | 某元素的一种核素代表该元素的一种原子 | |
| D. | 某种同位素或核素代表该元素的一种原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com