
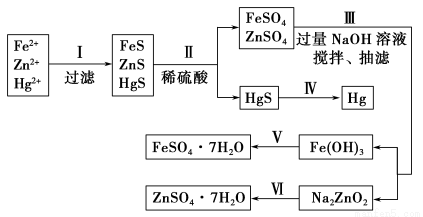
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为 。
(2)步骤Ⅲ中抽滤的目的是 ,该步骤产生Fe(OH)3的反应的离子方程式为 。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为 。
(4)欲实现步骤Ⅴ,需加入的试剂有 、 ,所涉及的主要操作依次为 。
(5)步骤Ⅳ常用的方法是 ,该步骤是否对环境有影响? (填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应: 。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为 。
(1)FeS+2H+=Fe2++H2S↑、ZnS+2H+=Zn2++H2S↑
(2)加快过滤 4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓(分步书写也可)
(3)ZnO22-+4H+=Zn2++2H2O
(4)稀硫酸 铁粉(过量) 过滤、浓缩结晶
(5)加热 是 在密闭容器中加热HgS
(6)3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O
【解析】(1)步骤Ⅱ中只有FeS、ZnS固体溶解在稀硫酸中生成FeSO4、ZnSO4,反应的离子方程式为FeS+2H+=Fe2++H2S↑、ZnS+2H+=Zn2++H2S↑。
(2)抽滤时产生负压,能加快过滤。向FeSO4和ZnSO4的混合溶液中加入过量NaOH溶液时,Fe2+与OH-反应生成Fe(OH)2,Fe(OH)2迅速被空气中的O2氧化为Fe(OH)3,其反应的离子方程式为4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓。
(3)根据框图转化关系,不难发现Zn(OH)2的性质类似于Al(OH)3的,Na2ZnO2的性质类似于NaAlO2的,所以向Na2ZnO2的溶液中加入过量H2SO4生成ZnSO4溶液,其反应的离子方程式为ZnO22-+4H+=Zn2++2H2O。
(4)Fe(OH)3首先与稀H2SO4反应生成Fe2(SO4)3,Fe2(SO4)3再与过量的Fe粉反应得到FeSO4。经过滤除去Fe粉,将滤液经过浓缩结晶可得FeSO4·7H2O。
(5)HgS在空气中加热可得Hg、SO2,由于Hg蒸气和SO2都会对环境造成污染,在密闭容器中加热HgS可有效防止Hg蒸气和SO2释放到大气中,从而保护了环境。
(6)反应物有ClO-、Fe(OH)3、OH-,生成物有Cl-、FeO42-、H2O,则有ClO-+Fe(OH)3+OH-―→FeO42-+Cl-+H2O,再将该离子方程式配平即可。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.11.2 L N2所含分子数为0.5NA
B.常温下,16 g CH4中共用电子对的数目为4NA
C.一定温度下,1 mol FeCl3水解生成NA个Fe(OH)3胶体颗粒
D.在反应H2O2+Cl2=2HCl+O2中,每生成32 g氧气,转移4NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:选择题
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。
①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;
②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;
③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。
下列说法正确的是 ( )。
A.V1=V3>V2 B.V2>V1=V3
C.V1=V2>V3 D.V1>V3>V2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:填空题
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A―→Q+B ②L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为 。
(3)某同学写出下面三个含氮的物质相互转换的关系式:
Ⅰ.M+P―→N2O3+H2O
Ⅱ.N2O4+H2O―→P+Q
Ⅲ.M+L―→Q+H2O
其中一定不可能实现的是 ,理由是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是 ( )。
A.S2Cl2既作氧化剂又作还原剂
B.氧化产物与还原产物物质的量之比为3∶1
C.每生成1 mol SO2转移4 mol电子
D.H2O作还原剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:选择题
下列实验现象所对应的离子方程式不正确的是 ( )。
选项实验现象离子方程式
A将稀硫酸滴加到KI淀粉溶液中在空气中放置一段时间后溶液呈蓝色4H++4I-+O2=2I2+2H2O
B用硫氰化钾溶液检验某溶液中含有Fe3+溶液变成红色Fe3++3SCN-= Fe(SCN)3
C酸性KMnO4溶液中加入Na2SO3溶液溶液紫色褪去2MnO4-+5SO32-+6H+ =2Mn2++5SO42-+3H2O
D将稀硫酸滴加到含有酚酞的Ba(OH)2溶液中有白色沉淀生成,溶液由红色变成无色Ba2++OH-+H++SO42- =BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:填空题
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果。例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢、高碳钢,利用数轴分类法可将其表示为:

根据这一分类方法请回答:
(1)25 ℃将pH与溶液酸碱性的关系粗略地表示在如下数轴上:

(2)某化学兴趣小组欲研究H2SO4、KCl、NaCl、Na2CO3、Na2SO3、NaOH六种物质的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。
方法Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7。由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类是否合理?为什么? 。
②在方案Ⅰ中,某同学发现盐类物质中的KCl、NaCl在与其他物质混合时现象相同,无法区分,请设计一种简单的方法区分这两种物质 。
③在方案Ⅱ中,三种钠盐用其他物质中的 可加以区分,有关反应的化学方程式分别为 。
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类。在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,请设计一个实验来解决这一难题: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1)所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数的数值,则下列叙述中正确的是 ( )。
A.所得溶液的物质的量浓度为1 mol·L-1
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:w=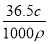
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:选择题
已知一定温度下,有下列难溶电解质的溶解平衡数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
则对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是 ( )。
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO42-)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调节pH至3~4后过滤,能得到纯净的CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com